
- •Лабораторная работа
- •2.2. Химическая связь в комплексных соединениях.
- •2.3 Номенклатура комплексных соединений.
- •Свойства комплексных соединений и реакции обмена с участием комплексных ионов.
- •2.5. Получение и разрушение комплексных соединений.
- •2.6.Окислительно-восстановительные реакции с участием комплексных соединений.
- •Порядок выполнения работы.
- •Различие между двойной и комплексной солью.
- •Образование и разрушение комплексных ионов.
- •3.3. Окислительно – восстановительные реакции с участием комплексных соединений.
- •Влияние концентрации раствора на комплексообразование.
- •Содержание отчёта.
2.2. Химическая связь в комплексных соединениях.
Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
-
Связь между комплексообразователем и лигандами донорно-акцепторная σ-типа. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали.
-
Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов.
-
Дополнительное упрочение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда.
-
Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных 3d–элементами: кобальтом, никелем и медью. В таблице собственные электроннные пары комплексообразователей изображены сплошными стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ-связи, представлены пунктирными стрелками.
|
Комплекс |
Заселённость орбиталей комплексообразователя |
Тип гибридизации ядра комплекса |
Структура комплекса |
|
Co3+ 3d 4s 4p 4d |
|
sp3d2 |
Октаэдр. |
|
|
|
sp3 |
Тетраэдр. |
|
|
|
sp |
Линейная |
Наряду с моноядерными комплексами, включающими только один центральный атом, существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атомов-комплексообразователей.
Помимо МВС для описания комплексных соединений широко используют Теорию кристаллического поля (ТКП), основанную на электростатической модели, её усовершенствованную модель – Теорию поля лигандов (ТПЛ), в которой электростатическое взаимодействие дополнено идеей перекрывания орбиталей, и, наконец, Метод молекулярных орбиталей (ММО).
2.3 Номенклатура комплексных соединений.
Названия комплексных соединений, применяемые в настоящее время, утверждены комиссией по номенклатуре неорганических соединений Международного Союза по теоретической и прикладной химии (IUPAC). Ниже приведены некоторые правила, заимствованные из материалов этой комиссии.
-
Порядок перечисления ионов. Первым называют катион, затем – анион.
-
Окончания координационных групп. Нейтральные группы называются также, как и молекулы. Исключениями являются акво (Н2О) и амин (NH3). К отрицательно заряженным ионам прибавляют окончания «о».
-
Окончания названий комплексов. Характерным окончанием для анионных комплексов является «ат» или «овая», если называется кислота. Для катионных и нейтральных комплексов типичных окончаний нет.
-
Степень окисления комплексообразователя обозначается арабской цифрой в скобках после его названия.
[Ag(NH3)2]Cl – диаминаргенто (1+) хлорид
K2[CuCl3] – калия трихлоркупрат (1+)
H2[Pt(CN)6] – гексацианоплатиновая кислота или водорода гексацианоплатинат (4+)
[Al(H2O)6]Cl3 гексааквоалюминий хлорид
[Cu(NH3)2]OH – диаминмедь (1+) гидроксид
K4[SnF8] – калия октафторстаннат (4+)














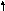
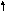
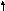
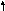
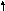






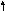

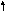

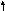

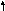




 [NiCl4]2-
[NiCl4]2- [Cu(NH3)2]+
[Cu(NH3)2]+