
-
Растворы. Дисперсные системы .
Контрольные вопросы
1. Опишите растворы как гомогенные системы.
2. Дайте определения способам выражения состава растворов (массовая доля, молярная и нормальная концентрации).
3. Охарактеризуйте свойства разбавленных молекулярных растворов (понижение давления пара растворителя, повышение температуры кипения, понижение температуры замерзания, осмотическое давление).
4. Охарактеризуйте растворы электролитов, их отличия от молекулярных растворов.
5. Приведите основные положения теории электролитической диссоциации С. Аррениуса и сольватной теории Д.И. Менделеева.
6. Дайте определение степени диссоциации электролитов. Как подразделяют электролиты по степени диссоциации? Приведите примеры ступенчатой диссоциации многоосновных кислот и многокислотных оснований.
7. Охарактеризуйте диссоциацию слабых электролитов как обратимый процесс. Приведите вывод уравнения закона разбавления Оствальда.
8. Объясните, почему константа диссоциации сильных электролитов изменяется с изменением концентрации.
9. Чем определяется направленность реакций в растворах электролитов? Приведите формулировку правила Бертолле.
10. Охарактеризуйте воду как слабый электролит константой диссоциации. Что такое водородный показатель? Как он характеризует кислотность раствора?
11. Покажите, как растворимость малорастворимых веществ характеризуется произведением растворимости (ПР).
На вопросы 12-20 студенты специальности «Инженерная защита окружающей среды» не отвечают.
12. Дайте определение дисперсных систем, дисперсной фазы и дисперсионной среды. Приведите классификацию дисперсных систем по агрегатному состоянию фаз. Приведите примеры дисперсных систем.
13. Охарактеризуйте коллоидные растворы, их подразделение на лиофобные и лиофильные.
14. На примере рассмотрения границы раздела фаз жидкость – газ объясните, что такое свободная поверхностная энергия и поверхностное натяжение.
15. Опишите поверхностные явления – адсорбцию и десорбцию. Дайте определения понятиям – адсорбент, адсорбат, адсорбтив.
16. Опишите строение коллоидной частицы.
17. Объясните механизм возникновения и строение двойного электрического слоя на поверхности коллоидных частиц.
18. Опишите методы получения коллоидных растворов.
19. Объясните что такое коагуляция и седиментация коллоидных растворов, как их вызвать и как предотвратить.
20. Опишите оптические и кинетические свойства коллоидных растворов.
Примеры выполнения заданий
|
Дано: СН(AlCl3)=0,3 моль-экв/л Vр-ра=200мл=0,2 л |
Решение.
Найдем массу соли: mв-ва=CнMfVр-ра, М(AlCl3)= 27+335,5=133,5 (г/моль); f(AlCl3) =1/3 m(AlCl3)=0,3133,50,21/3=26,7 (г) |
|
Найти: m(AlCl3). |
Ответ: m(AlCl3)=26,7 г.
Пример 2. Составьте выражения констант диссоциации для угольной и сернистой кислот. Пользуясь таблицей 7, определите, какая из них является более слабым электролитом. Рассчитайте степень диссоциации сернистой кислоты в 0,001 М растворе.
H 2CO3
H+
+ HCO3-
2CO3
H+
+ HCO3- ![]()
H CO3-
H+
+ CO32-
CO3-
H+
+ CO32- 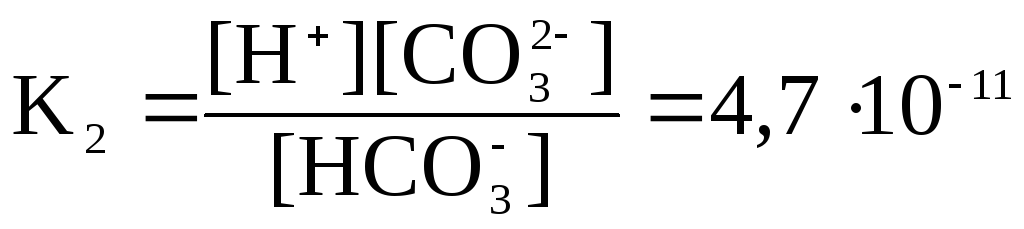
Kобщ = K1K2 = 4,510-74,710-11=2,110-17
H 2SO3
H+
+ HSO3-
2SO3
H+
+ HSO3- ![]()
H SO3-
H+
+ SO32-
SO3-
H+
+ SO32-

Kобщ=K1K2=110-9
Из сравнения значений констант диссоциации угольной и сернистой кислот видно, что угольная кислота более слабая (K(H2CO3) K(H2SO3)).
|
Дано: К(H2SO3)=110-9 CM=0,001моль/л=10-3моль/л |
Решение: = |
|
Найти: (H2SO3) |
Ответ: =10-3. |
Пример 3. Составьте выражения ПР гидроксидов магния и железа(II), пользуясь таблицей 6, сравните их растворимость.
В насыщенных водных растворах труднорастворимых веществ устанавливаются гетерогенные равновесия между осадком и ионами электролита в растворе:
M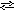 g(OH)2(к)
Mg2+
+ 2OH- ПР(Mg(OH)2)
= [Mg2+][OH-]2
= 2,310-13
g(OH)2(к)
Mg2+
+ 2OH- ПР(Mg(OH)2)
= [Mg2+][OH-]2
= 2,310-13
F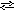 e(OH)2(к)
Fe2+
+ 2OH- ПР(Fe(OH)2
)= [Fe2+][OH-]2
=7,910-16
e(OH)2(к)
Fe2+
+ 2OH- ПР(Fe(OH)2
)= [Fe2+][OH-]2
=7,910-16
ПР(Mg(OH)2)ПР(Fe(OH)2) .
Растворимость гидроксида магния больше растворимости гидроксида железа(II).
Пример 4. Произведение растворимости AgIO3 равно 3,210-8 при 25oC. Рассчитайте молярную концентрацию AgIO3 в его насыщенном при данной температуре растворе.
|
ПР(AgIO3)=3,210-8
|
Решение: A |
|
Найти: СМ. |
Находим молярную концентрацию AgIO3 в его насыщенном растворе над осадком: ПР=[Ag+][IO3-], СМ(AgIO3)=[Ag+]=[IO3-]= |
Ответ: СМ=1,7910-4 моль/л.
Пример5. Рассчитайте концентрацию ОН- - ионов, а также рН и рОН раствора, укажите реакцию среды, если [H+]=8,3210-4 моль/л.
|
Дано: |
Решение. pH= - lg[H+] |
|
[H+]=8,3210-4моль/л |
pH=-lg8,3210-4=-(lg8,32+lg10-4)=-(0,92-4)=3,08; pH7 |
|
Найти: [OH-], pH, pOH, указать среду. |
Кв=[H+][OH-]=10-14;
|
рОН=-lg[OH-]; pOH= - lg1,210-11= - (lg1,2+lg10-11)= - (0,08-11)=10,92
Проверка: рН+рОН=14; 3,08+10,92=14
Ответ: [OH-]=1,210-11моль/л; рОН=10,92; рН=3,08; среда кислая.
Пример 6. Какие из указанных солей подвергаются гидролизу: нитрат лития, сульфат хрома (III), ортофосфат натрия, сульфид хрома (III)? Приведите ионные и молекулярные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия.
Гидролизу подвергаются те растворимые соли, которые образованы слабым основанием (гидролиз по катиону) или слабой кислотой (гидролиз по аниону), т.к. лишь взаимодействие их ионов приводит к образованию слабого электролита (связыванию ионов) и смещению ионного равновесия диссоциации воды.
Алгоритм составления уравнений обратимого гидролиза:
1.Составьте краткое ионное уравнение взаимодействия одного иона слабого электролита с одной молекулой воды. Укажите рН раствора соли ( или 7), а также влияние подкисления или подщелачивания среды на смещение равновесия гидролиза (в соответствии с принципом Ле-Шателье).
2.Составьте полное ионное уравнение, приписав к левой и правой частям уравнения формулы ионов сильного электролита, не участвующих в гидролизе.
3.Составьте молекулярное уравнение гидролиза соли по первой ступени, при необходимости расставьте коэффициенты.
4.Если гидролиз идет по трехзарядному иону, составьте уравнения гидролиза по второй ступени, повторив действия 1-3 и приняв за исходную соль продукт первой ступени. Учтите, что число стадий гидролиза по многозарядному иону, реально протекающих при обычных условиях, как правило, на одну меньше, чем заряд иона, т.к. каждая последующая стадия привела бы к образованию более сильного электролита.
Решение.
LiNO3 – соль образована сильным основанием (LiOH) и сильной кислотой (HNO3), гидролизу не подвергается, т.к. ионы Li+ и NO3- не образуют с водой слабых электролитов, рН=7.
Cr2(SO4)3 – соль образована слабым основанием (Cr(OH)3), и сильной кислотой (H2SO4), гидролиз по катиону.
I ступень Cr3+
+ HOH CrOH2+
+ H+ pH7
ступень Cr3+
+ HOH CrOH2+
+ H+ pH7
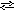 Cr3+
+ SO42-
+ HOH [CrOH]2+
+ H+
+ SO42-
Cr3+
+ SO42-
+ HOH [CrOH]2+
+ H+
+ SO42-
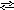 Cr2(SO4)3
+ 2HOH 2[CrOH]SO4
+ H2SO4
Cr2(SO4)3
+ 2HOH 2[CrOH]SO4
+ H2SO4
I I
ступень [CrOH]2+
+ HOH [Cr(OH)2]+
+ H+
I
ступень [CrOH]2+
+ HOH [Cr(OH)2]+
+ H+
 [CrOH]2+
+ SO42-
+ HOH [Cr(OH)2]+
+ H+
+ SO42-
[CrOH]2+
+ SO42-
+ HOH [Cr(OH)2]+
+ H+
+ SO42-
2 [CrOH]SO4
+ 2HOH [Cr(OH)2]2SO4
+ H2SO4
[CrOH]SO4
+ 2HOH [Cr(OH)2]2SO4
+ H2SO4
По третьей ступени гидролиз практически не идет, т.к. это привело бы к образованию более сильного электролита Cr(OH)3, чем Cr(OH)2+.
Усилить гидролиз можно связыванием протонов в воду, т.е. добавлением щелочи, а также нагреванием и разбавлением раствора. К смещению равновесия гидролиза влево приведет добавление кислоты.
Na3PO4 – соль образована сильным основанием (NaOH) и кислотой средней силы (H3PO4), гидроанионы которой являются слабыми электролитами (гидролиз по аниону).
I ступень
PO43-
+ HOH HPO42-
+ OH- pH7
ступень
PO43-
+ HOH HPO42-
+ OH- pH7
 PO43-
+ Na+
+ HOH HPO42-
+ Na+
+ OH-
PO43-
+ Na+
+ HOH HPO42-
+ Na+
+ OH-
 Na3PO4
+ HOH Na2HPO4
+ NaOH
Na3PO4
+ HOH Na2HPO4
+ NaOH
I I
ступень HPO42-
+ HOH H2PO4-
+ OH-
I
ступень HPO42-
+ HOH H2PO4-
+ OH-
N a+
+ HPO42-
+ HOH H2PO4-
+ Na+
+ OH-
a+
+ HPO42-
+ HOH H2PO4-
+ Na+
+ OH-
N aHPO4
+ HOH
NaH2PO4
+ NaOH
aHPO4
+ HOH
NaH2PO4
+ NaOH
Усиление гидролиза возможно при добавлении кислоты, нагревании, разбавлении. Подщелачивание среды приведет к смещению равновесия влево.
По третьей ступени гидролиз при обычных условиях практически не идет, т.к. H3PO4 более сильный электролит, чем H2PO4-.
Cr2S3 – соль образована слабым многокислотным нерастворимым основанием Cr(OH)3 и слабой многоосновной летучей кислотой – H2S. Такие соли подвергаются полному необратимому гидролизу. При этом сразу образуются конечные продукты гидролиза – осадок слабого основания и летучая кислота.
Cr2S3 + 6H2O =2Cr(OH)3 + 3H2S pH7.
Задания для самостоятельного решения
Задание 1. Решите расчетную задачу.
1. Сколько г Na2CO3 содержится в 500 мл 0,25 н раствора?
2. Какая масса KCl потребуется для приготовления 250 мл 0,15 М раствора?
3. Найдите массу NaNO3, необходимую для приготовления 150 мл 2 М раствора.
4. В каком объеме 0,1 н CuSO4 содержится 8 г безводной соли?
5. В каком объеме 0,3 М раствора NaCl содержится 2 г соли?
6. Определите молярную концентрацию раствора, содержащего 11,2 г КОН в 200 мл раствора.
7. Сколько г Na2CO3 содержится в 500 мл 0,25 н раствора?
8. Определите молярную концентрацию раствора Na2SO4, содержащего 42 г соли в 300 мл раствора.
9. Вычислите молярную концентрацию Ва(ОН)2 в растворе, если в 2 л его содержится 2 г щелочи.
10. Сколько г NaBr потребуется для приготовления 700 мл 0,15 н раствора соли?
11. Какая масса KCl потребуется для приготовления 250 мл 1,15 М раствора соли?
12. Найдите массу NaOH, необходимую для приготовления 2 л 0,3 н раствора.
13. В каком объеме 2 М раствора NaCl содержится 5 г соли?
14. Какова концентрация раствора, содержащего 9 г CaCl2 в 500 мл раствора?
15.В каком объеме 0,1 н раствора CuCl2 содержится 5 г соли?
Задание 2. Составьте уравнения диссоциации соединений, формулы которых приведены ниже. В тех случаях, где это необходимо, приведите уравнения ступенчатой диссоциации. Составьте выражения констант диссоциации предложенных кислот. Какая из двух является более слабой? Рассчитайте степень диссоциации одной из кислот в 0,01 М растворе.
|
№ вар. |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Кислоты |
HClO H3BO3 |
HNO2 H2Se |
H2S HIO |
H3BO3 HBrO |
HСlO2 H2CO3 |
H2SO3 HClO |
HBrO H2CO3 |
HIO H3PO4 |
|
№ вар. |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
Кислоты |
H2CO3 HCN |
H2SO3 HNO2 |
H2S COOH |
H3BO3 HNO2 |
H3PO4 HСlO2 |
HClO H2S |
H2Se СН3СООН |
|
Задание 3. Составьте выражения ПР указанных веществ, сравните их растворимость. Рассчитайте концентрацию катионов и анионов в насыщенном растворе одного из этих веществ.
|
№ вар. |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Вещества |
AgBr AgCl |
Mg(OH)2 MgS |
CaSO4 BaSO4 |
AgI AgCl |
FeS CuS |
SrSO4 BaSO4 |
CdS CuS |
AgBr AgI |
|
№ вар. |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
Вещества |
CaCO3 CaSO4 |
HgS CuS |
FeS Fe(OH)2 |
CuI AgI |
CuCl CuI |
Cu(OH)2 CuS |
Zn(OH)2 ZnS |
|
Задание 4. Рассчитайте концентрацию ионов ОН-, а также рН раствора, укажите реакцию среды, если концентрация ионов Н+ составляет:
|
№ вар. |
[H+], моль/л |
№ вар. |
[H+], моль/л |
№ вар. |
[H+], моль/л |
|
1 |
3,8210-12 |
2 |
9,1210-5 |
3 |
7,5510-7 |
|
4 |
2,8510-2 |
5 |
6,3810-10 |
6 |
4,5210-4 |
|
7 |
2,8810-6 |
8 |
8,8510-11 |
9 |
3,3310-3 |
|
10 |
5,2810-13 |
11 |
8,3210-6 |
12 |
1,8610-11 |
|
13 |
7,5610-1 |
14 |
6,2510-9 |
15 |
8,8410-12 |
Задание 5. Приведите молекулярные и ионные уравнения тех реакций, которые возможны в растворе, объясните их направленность.
|
№ вар. |
Схемы реакций |
№ вар. |
Схемы реакций |
|
1 |
Cu(OH)2 + Na2SO4 Na2SO4 + BaCl2 Fe(OH)3 + H2SO4 Al(OH)3 + NaOH Pb(NO3)2 + H2S |
2 |
NaOH + CaCO3 CaSO4 + SrCl2 [CuOH]2SO4 + HCl Cu(NO3)2 + H2S CuCl2 + AgNO3 |
|
3 |
H2CO3 + Ca(NO3)2 NaCl + LiNO3 Cr(OH)3 + KOH Na2CO3 + HCl Ca(HCO3)2 + Ca(OH)2 |
4 |
KCl + H2SO4 [NiOH]2SO4 + HCl Pb(NO3)2 + Cu(OH)2 Na2CO3 + Ca(NO3)2 NH4NO3 + NaOH |
|
5 |
CaCO3 + LiCl K2S + HCl Mg(OH)2 + Na2SO4 [FeOH]2SO4 + H2SO4 Pb(OH)2 + HNO3 |
6 |
Pb(OH)2 + KOH H2S + FeCl2 ZnSO4 + Cu(OH)2 NaH2PO4 + NaOH CaCl2 + Na2CO3 |
|
7 |
Cu(NO3)2 + BaSO4 Ba(OH)2 + H2SO4 CuSO4 + KCl Be(OH)2 + KOH Ba(HCO3)2 + NaOH |
8 |
HNO3 + K2SO4 Al(OH)3 + KOH KOH + Na2SO4 CaCO3 + H2O + CO2 BaS + CuSO4 |
|
9 |
Be(OH)2+KOH FeOHCl2+ HCl Na2SO4+K2CO3 NaNO3+Zn(OH)2 CaCl2+H2SO4 |
10 |
Na2SiO3 + HCl Cr(OH)3 + HNO3 CuCl2 + KNO3 CrOHSO4 + H2SO4 AgNO3 + CuCl2 |
|
11 |
Ba(NO3)2 + Na2SO4 CuOHCl + NaOH KNO3 + Na2CO3 Al(OH)3 + KCl Na2CO3 + H2SO4 |
12 |
CaS + HCl CoCl2 + KOH Pb(NO3)2 + KCl Be(OH)2 + Ba(OH)2 NaNO3 + H2SO4 |
|
13 |
BaCl2 + H2SO4 Na3PO4 + H2S NaOH + AlCl3 PbOHNO3 + HNO3 Na2S + KCl |
14 |
K2SO4 + H2SO3 BaS + CuSO4 Al(OH)3 + NaCl SrSO4 + CaCl2 Cr(OH)3 + NaOH |
|
15 |
Be(OH)2 + KOH AgNO3 + CaCl2 HNO3 + CaS KBr + Zn(OH)2 NaHSO4 + NaOH |
||
Задание 6*. Составьте молекулярные уравнения реакций, соответствующие следующим кратким ионным.
|
№ вар |
Краткое ионное уравнение |
№ вар |
Краткое ионное уравнение |
|
1 |
H2PO4-+OH-=HPO42-+H2O Pb2++SO42-=PbSO4 [Cr(OH)2]++2H+=Cr3++2H2O |
2 |
3Ag++PO43-=Ag3PO4 HCO3-+OH-=CO32-+H2O BaCO3+2H+=Ba2++CO2+H2O |
|
3 |
[Fe(OH)2]++2H+=Fe3++2H2O H2S+2Ag+=Ag2S+2H+ CO32-+2H+=CO2+H2O |
4 |
HAsO42-+OH-=AsO43-+H2O [AlOH]2++H+=Al3++H2O 2H++S2-=H2S |
|
5 |
HCO3-+H+=H2O+CO2 Ni(OH)2+2H+=Ni2++2H2O CO32-+Ca2+=CaCO3 |
6 |
FeOH2++2OH-=Fe(OH)3 MgCO3+2H+=Mg2++CO2+H2O Cu2++S2-=CuS |
|
7 |
SO32-+2H+=SO2+H2O [CuOH]++H+=Cu2++H2O 3Ca2++2PO43--=Ca3(PO4)2 |
8 |
H2S+Pb2+=PbS+2H+ BaSO3+2H+=Ba2++SO2+H2O [Fe(OH)2]++OH-=Fe(OH)3 |
|
9 |
H2PO4-+2OH-=PO43-+2H2O Pb2++2I-=PbI2 CaCO3+2H+=Ca2++CO2+H2O |
10 |
Pb2++2Br-=PbBr2 HS-+OH-=S2-+H2O BaSeO3+2H+=Ba2++SeO2+H2O |
|
11 |
HSO3-+OH-=SO32-+H2O Ag++I-=AgI Co(OH)2+2H+=Co2++2H2O |
12 |
[FeOH]++OH-=Fe(OH)2 Sr2++SO42+=SrSO4 SO32-+2H+=H2O+SO2 |
|
13 |
3Ba2++2PO43-=Ba3(PO4)2 HSe-+H+=H2Se Ag++Br-=AgBr |
14 |
[CuOH]++H+=Cu2++H2O H2S+2Ag+=Ag2S+2H+ H2AsO4-+2OH=2H2O+AsO43- |
|
15 |
Hg2++S2-=HgS, [Al(OH)2]++2H+=Al3++2H2O, H++OH-=H2O |
||
Задание 7*. Рассчитайте концентрацию ионов Н+ и ОН- в растворе, рН которого равен:
|
№ вар |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
рН |
4,3 |
10,8 |
2,6 |
12,5 |
8,3 |
11,6 |
1,8 |
6,7 |
|
№ вар |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
рН |
9,4 |
3,8 |
9,3 |
2,3 |
13,2 |
5,6 |
1,1 |
|
Задание 8*. Какие из указанных солей подвергаются гидролизу? Приведите молекулярные и ионные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия гидролиза.
|
№ вар |
Названия солей |
|
1 |
Фосфат калия, сульфат меди (II), хлорид рубидия, сульфид алюминия |
|
2 |
Ацетат аммония, нитрат хрома(III), карбонат лития, сульфат цезия |
|
3 |
Нитрат натрия, сульфид бария, хлорид железа(III), сульфид железа (III) |
|
4 |
Хлорид бария, сульфид натрия, сульфат меди(II), карбонат хрома(III) |
|
5 |
Сульфит калия, нитрат кобальта(II), нитрат калия, сульфид хрома(III) |
|
6 |
Иодид лития, сульфит натрия, нитрат алюминия, карбонат аммония |
|
7 |
Ацетат натрия, сульфат железа(II), карбонат алюминия, бромид калия |
|
8 |
Нитрат свинца(II), нитрит аммония, сульфат калия, карбонат натрия |
|
9 |
Хлорид цинка, нитрат бария, сульфид алюминия, ацетат меди(II) |
|
10 |
Нитрит кальция, нитрат никеля(II), карбонат железа(III), хлорид рубидия |
|
11 |
Бромид калия, сульфид натрия, хлорид меди(II), сульфид хрома(III) |
|
12 |
Нитрат меди(II), сульфид кальция, нитрат стронция, сульфид аммония |
|
13 |
Хлорид меди(II), фосфат цезия, сульфат калия, сульфид железа(II) |
|
14 |
Нитрат натрия, хлорид бериллия, фосфат калия, сульфит аммония |
|
15 |
Сульфат алюминия, нитрит бария, хлорид калия, сульфид алюминия |
Задание 9*. Приведите молекулярные и краткие ионно-молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их протекания:
|
№ вар |
Превращения |
№ вар |
Превращения |
|
1 |
BaCO3Ba(HCO3)2BaCO3 Fe2O3Fe(OH)3 CuCuSO4 Cu(NO3)2CuOHNO3Cu(NO3)2 Na2SO4NaCl |
2 |
ZnOZn(OH)2 Ca3(PO4)2CaHPO4Ca3(PO4)2 FeCl3FeOHCl2FeCl3 KNO3HNO3 FeFeCl2 |
|
3 |
HgHg(NO3)2 ZnSO4(ZnOH)2SO4ZnSO4 Na3PO4NaCl K2SO3KHSO3K2SO3 MgOMg(OH)2 |
4 |
KClKNO3 CuCuCl2 PbOPb(OH)2 MgCO3Mg(HCO3)2MgCO3 AlCl3Al(OH)2ClAlCl3 |
|
5 |
FeFe(NO3)2 CuSO4CuCl2 Al2O3Al(OH)3 FeCl2FeOHClFeCl2 K3PO4KH2PO4K3PO4 |
6 |
K2SKHSK2S CuOCu(OH)2 Cr2(SO4)3CrOHSO4Cr2(SO4)3 KClHCl AlAl2(SO4)3 |
|
7 |
Cr(NO3)3CrOH(NO3)2Cr(NO3)3 SnOSn(OH)2 K2CO3KHCO3K2CO3 K3PO4KNO3 CuCu(NO3)2 |
8 |
FeFeCl3Ba3(PO4)2Ba(H2PO4)2Ba3(PO4)2 FeOFe(OH)2 AlCl3AlOHCl2AlCl3 K2SO4KCl |
|
9 |
MnOMn(OH)2 Al2(SO4)3[Al(OH)2]2SO4Al2(SO4)3 BaCl2Ba(NO3)2 CaCO3Ca(HCO3)2CaCO3 MgMg(NO3)2 |
10 |
ZnCl2ZnOHClZnCl2 Na2SO3NaHSO3Na2SO3 Cr2O3Cr(OH)3 CuSO4Cu(NO3)2 FeFeSO4 |
|
11 |
Na3PO4NaH2PO4Na3PO4 NiONi(OH)2Al(NO3)3Al(OH)2NO3Al(NO3)3 AgAgNO3 NaNO3Na2SO4 |
12 |
CoOCo(OH)2 Al2(SO4)3[Al(OH)2]2SO4 Al2(SO4)3 KClK2SO4 AlAlCl3 Na2CO3NaHCO3Na2CO3 |
|
13 |
CrCl3Cr(OH)2ClCrCl3 BeOBe(OH)2 Na2SO4NaNO3 ZnZn(NO3)2 Mg3(PO4)2Mg(H2PO4)2Mg3(PO4)2 |
14 |
Na2SNaHSNa2S Fe2O3Fe(OH)3 Pb(NO3)2PbOHNO3Pb(NO3)2 KNO3K2SO4 AlAl2(SO4)3 |
|
15 |
PbOPb(OH)2, K3PO4KCl, PbPb(NO3)2 CaSO3Ca(HSO3)2CaSO3, Fe2(SO4)3FeOHSO4Fe2(SO4)3 |
||
Задание 10*. Приведите уравнения реакций получения следующих веществ всеми известными вам способами, укажите условия:
|
№ вар |
Вещества |
|
1 |
оксид меди (II), гидроксид натрия, хлороводородная кислота, фосфат калия |
|
2 |
оксид свинца (II), гидроксид бериллия, сульфат меди(II), сероводород |
|
3 |
оксид алюминия, гидроксид бария, азотная кислота, нитрат свинца(II) |
|
4 |
оксид железа (II), гидроксид меди(II), кремниевая кислота, хлорид бария |
|
5 |
оксид фосфора(V), гидроксид цинка, селеновая кислота, фосфат бария |
|
6 |
оксид цинка, гидроксид лития, сернистая кислота, сульфат железа(II) |
|
7 |
оксид кальция, гидроксид свинца(II), фосфорная кислота, нитрат алюминия |
|
8 |
оксид углерода(IV), гидроксид стронция, селеноводород, хлорид железа(II) |
|
9 |
оксид магния, гидроксид алюминия, хлорная кислота, сульфат цинка |
|
10 |
оксид олова(II), гидроксид калия, соляная кислота, нитрат магния |
|
11 |
оксид марганца(II), гидроксид железа(III),бромоводород, хлорид алюминия |
|
12 |
оксид никеля, гидроксид кальция, азотистая кислота, сульфат цинка |
|
13 |
оксид железа(III), гидроксид никеля(II), серная кислота, хлорид кальция |
|
14 |
оксид бария, гидроксид марганца(II), соляная кислота, нитрат железа(III) |
|
15 |
оксид стронция, гидроксид олова(II), хлорноватистая кислота, карбонат кальция |
Тестовые задания для самоконтроля
1. Количество молей вещества в единице объема раствора –
-
молярная концентрация;
-
нормальная концентрация;
-
массовая доля.
2. Отношение массы растворенного вещества к массе раствора –
-
массовая доля;
-
нормальная концентрация;
-
молярная концентрация.
3. Растворимость газа пропорциональна его парциальному давлению над раствором –
-
Закон Генри;
-
Закон Рауля;
-
Закон Вант-Гоффа.
4. Какой из приведенных электролитов относится к сильным?
-
H2S;
-
H2O;
-
HCl.
5. Какая реакция из числа приведенных не возможна в растворе?
-
Be(OH)2+2KOH=K2[Be(OH)4];
-
KOH+HNO3=KNO3+H2O;
-
KOH+NaNO3=KNO3+ NaOH.
6. Отрицательный логарифм концентрации ионов водорода в растворе:
-
К нестойкости;
-
ПР;
-
рН.
7. Автором гидратной теории растворов является:
-
С.Аррениус;
-
Д.И.Менделеев;
-
Н.К Курнаков.
8. Электролиты, при диссоциации которых в качестве анионов образуются только ОН-- ионы, - это:
-
кислоты;
-
основания;
-
соли.
9. Молекулы какого вещества подвергаются в растворе ступенчатой диссоциации?
-
Na2SO4;
-
HBr;
-
H2SO3.
10. Уравнение Кд = α2с является выражением закона:
-
Рауля;
-
Вант-Гоффа;
-
Оствальда.
Ключи к тестовым заданиям
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
№ ответа |
1 |
1 |
1 |
3 |
3 |
3 |
2 |
2 |
3 |
3 |

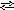 gIO3(к)
Ag++IO3-
gIO3(к)
Ag++IO3-