
- •Цвет меди и её соединений
- •Электропроводимость
- •Кристаллическая решетка меди
- •Окончание табл. 1
- •Химические свойства меди
- •Отношение к кислороду
- •Взаимодействие с водой
- •Получение меди
- •1. Метод электролиза
- •2. Металлотермический метод получения
- •3. Пирометаллургический способ получения меди
- •Опыт 1 Получение меди электролизом раствора. Определение электрохимического и химического эквивалентов меди
- •Теоретическая часть Никель Физические и химические свойства
- •Получение никеля
- •Опыт 2 Получение никелевого покрытия методом электроосаждения
- •Экспериментальная часть
- •Домашнее задание к лабораторной работе
- •Лабораторная работа № 2 физико-химические свойства полимерных материалов
- •Теоретическая часть Высокомолекулярные соединения
- •Продолжение табл. 1
- •Окончание табл. 1
- •Специальные добавки в пластмассы
- •Отношение волокон к реагентам
- •Окончание табл. 3
- •Полимеры классифицируют по следующим признакам.
- •Экспериментальная часть Опыт 1 Свойства полиэтилена (пэ) и полистирола (пс)
- •Опыт 2 Свойства поливинилхлорида (пвх)
- •Опыт 3 Свойства полиметилметакрилата (пмма)
- •Опыт 4 Свойства капрона
- •Физико-химические свойства полимерных материалов
- •Лабораторная работа № 3 получение стекол
- •Теоретическая часть Неорганические диэлектрики
- •Керамика
- •Установочная керамика
- •Основные свойства установочной радиокерамики
- •Основные свойства конденсаторной керамики
- •Сегнетокерамика
- •Вакуумная керамика
- •Жаростойкая керамика
- •Свойства нагревостойкой керамики
- •Основные физические, механические, электрические и химические свойства стекол
- •Химический состав некоторых промышленных стекол в весовых %
- •Опыт 1 Получение легкоплавких силикатных стекол
- •Окончание таблицы
- •Домашнее задание к лабораторной работе
- •Шкала коррозионной стойкости металлов по гост 5272-50
- •Экспериментальная часть
- •Определение скорости коррозии
- •Примечание
- •Диапазон сопротивлений
- •Опыт 1 Влияние pH среды на скорость коррозии железа. Измерение скорости коррозии
- •Гальванические покрытия
- •Подготовка поверхности
- •Экспериментальная часть
- •Определение никеля
- •Защита от коррозии Опыт 2 Скорость коррозии луженого железа в кислой среде
- •Опыт 3 Анодное и катодное покрытие для железа
- •Опыт 4 Влияние ингибиторов
- •Контрольные вопросы
- •Домашнее задание к лабораторной работе
- •Приложение 1
- •Приложение 2 Химия радиоматериалов Вариант 1
- •Химия радиоматериалов Вариант 2
- •Химия радиоматериалов Вариант 3
- •Химия радиоматериалов Вариант 4
- •Приложение 3 План ргр
- •Варианты
- •Приложение 4
- •Список литературы
- •Химия радиоматериалов сборник лабораторных работ и домашних заданий
- •6 30092, Г. Новосибирск, пр. К. Маркса, 20
Химические свойства меди
Строение атома
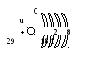 29Cu
1s1 2s2
2p6
3s2
3p6
3d10
4s1
29Cu
1s1 2s2
2p6
3s2
3p6
3d10
4s1
Eионизации 1 = 7.72 эВ
Eионизации 2 = 20.29 эВ
Eионизации 3 = 36.83 эВ
Отношение к кислороду
Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:
2Cu + O2 + + H2O + CO2 → Cu2(OH)2CO3 .
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди(I): 4Cu + O2 → 2Cu2O.
Внешне медь при этом не меняется, так как оксид меди (I), как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т. е. просвечивает. По-иному медь окисляется при нагревании, например, при 600…800 °C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие.
Qобразования (Cu2O) = 84935 кДж.


Строение оксидной пленки меди
Взаимодействие с водой
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например: Fe + CuCl2 → Cu + FeCl2. Эта реакция окислительно-восстановительная, так как происходит переход электронов:
Fe – 2e-→ Fe2+
Cu2+ + 2e-→ Cu0
Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода.
CuSO4 +
H2![]() Cu
+ H2SO4
.
Cu
+ H2SO4
.
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
2Cu + O2 + 2H2O → 2Cu(OH)2
2Cu + O2 + H2O + CO2 → Cu2(OH)2CO3
Получение меди
1. Метод электролиза
Электролиз широко применяют для очистки (рафинирования) меди. Для очистки меди из черновой меди отливают аноды – толстые пластины. Их подвешивают в ванну, содержащую раствор медного купороса. В качестве катодов используют тонкие листы чистой меди, на которые во время электролиза осаждается чистая медь. На аноде происходит растворение меди. Ионы меди передвигаются к катоду, принимают от катода электроны и переходят в атомы: Cu2+ + 2e- → Cu. Чистая медь оседает на катоде.
Примеси, входящие в состав черновой меди, ведут себя по-разно-му. Более электроотрицательные элементы – цинк, железо, кадмий и другие растворяются на аноде. Но на катоде эти металлы не выделяются, так как в электрохимическом ряду напряжений они находятся левее меди и имеют более отрицательные потенциалы.
2. Металлотермический метод получения
3CuO + 2Al → Al2O3 + 3Cu
3CuО + 2Fe → Fe2O3 + 3Cu + Q
3. Пирометаллургический способ получения меди
Поскольку содержание меди в рудах не превышает 1.5–2 %, их подвергают обогащению, т. е. отделяют соединения меди от пустой породы, применяя флотационный метод. Для этого руду размалывают до тончайшего порошка и смешивают его с водой, добавив в неё предварительно флоторагенты – сложные органические вещества. Они покрывают мельчайшие крупинки соединений меди и сообщают им несмачиваемость. В воду добавляют ещё вещества, создающие пену. Затем через взвесь пропускают сильный поток воздуха. Поскольку частички (крупинки соединений меди) водой не смачиваются, они прилипают к пузырькам воздуха и всплывают наверх. Всё это происходит во флотационных аппаратах. Пену, которая содержит крупинки соединений меди, собирают, отфильтровывают, отжимают от воды и высушивают. Так получают концентрат, из которого выделяется медь. В зависимости от состава руды существует несколько методов её переработки.
Сульфидную руду сначала обжигают при свободном токе воздуха для удаления части серы: 2CuS + 3O2 → 2CuO + 2SO2. Этот обжиг проводят в механических печах, похожих на устройства для обжига серного колчедана. В последнее время начали применять обжиг в кипящем слое. Продукты обжига затем переплавляют совместно с флюсами в отражательной печи. При этом протекает множество химических процессов, например:
2CuO + 4CuS → 3Cu2S + SO2 .
Пустая порода, часть сульфидов и окислов железа переходят в шлак, а на дне печи скапливается штейн – расплав сульфида меди Cu2S и сульфида железа FeS. Штейн сливают из печи и перерабатывают в конвекторе, который по устройству похож на конвектор для переработки стали. Частичное удаление серы происходит за счет продувки воздуха через расплавленный штейн:
2Cu2S + 3O2 → 2Cu2O + 2SO2 .
Сульфид меди и закись меди дают металлическую черновую медь:
CuS + 2Cu2O → SO2 + 6Cu.
Она содержит около 95 – 98 % меди. При последующей переплавке на поду отражательной печи содержание меди может быть повышено до 99,7 %. Дальнейшая очистка меди проводится электролизом.
Более просто перерабатывают окисные руды меди, состоящие из закиси меди, окиси меди и карбонатов меди (Cu2O, CuO, CuCO3*Cu(OH)2). Эти руды обогащения прокаливают с коксом при высокой температуре: 2CuO + C→ CO2 + 2Cu.
