
- •Занятие 1 Расчет составов топлив
- •Занятие 2 Расчет теплоты сгорания, и ее температурной зависимости Пример 1: Рассчитать теплоту сгорания углерода
- •Решение: Теплота (или энтальпия реакции) сгорания определяется по формуле
- •Алгоритм решения
- •Алгоритм решения Составляется уравнение гидрирования до предельного соединения и уравнения горения и предельного гомолога Пример
- •Занятие 3 Расчет материального баланса периодического реактора
- •Занятие 4 Расчет тепловых балансов в теплотехнологии
- •Занятие 5 Расчет температур горения топлив
- •Занятие 6 Использование уравнений полного и неполного сгорания для оценки качества сгорания топлива
- •Занятие 7 Расчеты кинетики реакций
- •Занятие 8 Расчет технико-экономических показателей и кпд в теплотехнологии
- •Список используемых источников
Алгоритм решения Составляется уравнение гидрирования до предельного соединения и уравнения горения и предельного гомолога Пример
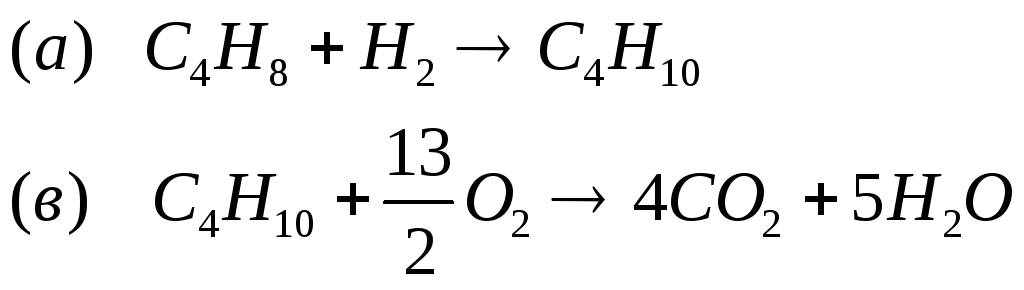
и реакция горения водорода
![]()
Искомая реакция равна (а)+(в)-(с). Определяя энтальпию каждой реакции по [1] получим искомую теплоту сгорания:
-
по примеру 2 использование закона дает формулу для энтальпиио
-
ΔH=ΔHа+ΔHв-ΔHc
Пример 3. Зная энтальпию образования воды при to=25oC ∆H(H2O)=-241,82 кДж/моль рассчитать энтальпию образования воды при t=100oC ∆H100(H2O)
Решение:
Мольные теплоемкости при постоянном давлении водорода, кислорода и воды: Cр(н2)=28,8 Дж/(моль·К); Ср(О2)=29,3 Дж/(моль·К); Ср(Н2О)=33,6 Дж/(моль·К).
∆Ср=
Cр(Н2О,
газ) -
![]() Cр(О2,
газ) - Cр(Н2,
газ)= -9,8 Дж/(моль·К).
Cр(О2,
газ) - Cр(Н2,
газ)= -9,8 Дж/(моль·К).
∆H100(Н2О )= ∆H(Н2О) + ∆Ср·∆T = -242,56 Дж/моль.
Задание 3. Рассчитать энтальпию сгорания CH4, C2H6, C3H8, C4H10 при температурах 250С С, 1000С, 2000С. Сравнить теплоты сгорания веществ CH4, C2H6, C3H8, C4H10 с результатами, полученными по формуле Менделеева:
Алгоритм решения:
-
Рассчитать по примеру 3 энтальпии сгорания веществ в реакции горения для заданной температуры.
-
По формуле Σ∆Hi(продукт) - Σ∆Hj(реагент) рассчитать теплоту сгорания при заданной температуре.
3. Теплота сгорания топлива, рассчитываемая по формуле Менделеева имеет вид
![]() Q
Q![]() 339,3·C
+ 1256·H
+ 109·(O
– S)
– 25,2·(9·H
+ W)
(2.5)
339,3·C
+ 1256·H
+ 109·(O
– S)
– 25,2·(9·H
+ W)
(2.5)
где C, H, O, S,W – процентное содержание элементов в газах CH4, C2H6, C3H8, C4H10 и топливе: мазут, сланцы, древесина, нефть.
Занятие 3 Расчет материального баланса периодического реактора
Основы материального баланса и основные определения
![]()
СН4прим







 исх.смесь
реакционная смесь
исх.смесь
реакционная смесь

 Н2О
смеситель
Н2О
смеситель
tп=105ºС
Задание. Рассчитать материальный баланс процесса со следующими исходными данными:
-
производительность по водороду: G=48 кг/час
-
подано в исходной смеси:
![]() (кг;
кмоль; м3)
(кг;
кмоль; м3)
![]() -
для любых газов
-
для любых газов
-
 СН4(t)
СН4(t)
СН4прореагир



(CH4)0


 CH4
непрореагир
t
CH4
непрореагир
t
Какова конверсия одного из компонентов (например, метана):
![]() (долей)
(долей)
![]()
По результатам решения заполняем таблицу
|
СН4 |
Н2О |
СО |
Н2 |
|
|
|
8 |
8 |
|
|
кмоль |
прореагировало |
|
8·16=128 |
8·18=144 |
|
|
кг |
|
|
|
|
8 |
24 |
кмоль |
получилось |
|
|
|
8·28=224 |
48 |
кг |
|
|
13,3 |
13,3·2=26,6 |
|
|
кмоль |
подано |
|
213,3 |
26,6·18=478,8 |
|
|
кг |
|
Исходная смесь |
Реакционная смесь |
||||
|
Наименование |
кг |
кмоль |
Наименование |
кг |
кмоль |
|
(СН4)0 |
213,3 |
13,3 |
Н2 |
48 |
24 |
|
(Н2О)0 |
478,8 |
26,6 |
СО |
224 |
8 |
|
|
|
|
СН4 |
85,3 |
5,3 |
|
|
|
|
Н2О |
18,6 |
18,6 |
|
ИТОГО: |
692,1 |
|
ИТОГО: |
692,1 |
|
