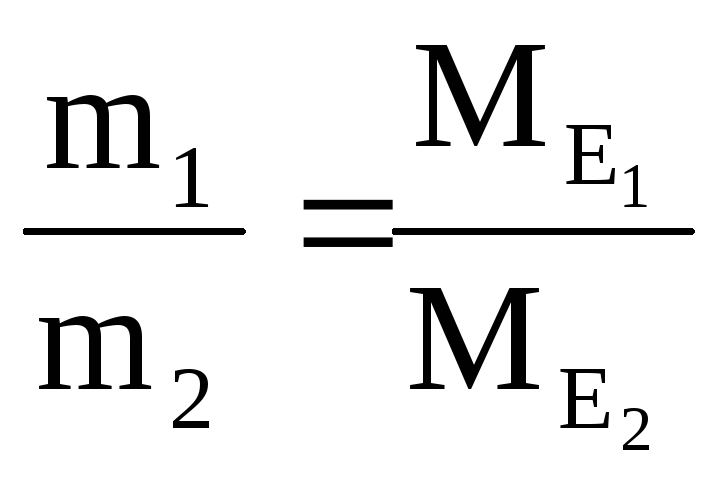- •Міністерство освіти і науки україни херсонський національний технічний університет
- •Рецензент: завідувач кафедри фізичної та біомедичної електроніки Херсонського національного технічного університету, доктор хімічних наук професор Новіков о.О.
- •1. Правила роботи в хімічній лабораторії
- •Запам'ятайте!
- •2. Основні хімічні поняття
- •Молярні маси еквівалентів складних речовин
- •3. Основні закони хімії
- •Контрольні питання та вправи
- •4. Класи неорганічних сполук
- •Одержання
- •Хімічні властивості
- •Хімічні властивості
- •Класифікація
- •Хімічні властивості
- •Одержання
- •Хімічні властивості
- •Одержання
- •Хімічні властивості
- •Контрольні питання та вправи
- •5. Будова атома
- •Основні принципи розподілу електронів в атомі
- •Контрольні питання та вправи
- •Лабораторна робота № 1
- •Хід роботи
- •Контрольні питання та вправи
- •Термодинамічні властивості хімічних сполук
- •Лабораторна робота № 2
- •Контрольні питання та вправи
- •Загальні властивості розчинів
- •Колігативні властивості розчинів
- •Розв’язання
- •Контрольні питання і задачі
- •Лабораторна робота № 3 приготування розчинів. Визначення концентрацій
- •Розв'язання
- •Приклад 2. Визначити об’єм розчину фосфатної кислоти з густиною 1,115 г/см3, який треба взяти для приготування розчину об’ємом () 100 мл з молярною концентрацією еквівалентів 0,1 моль/л? Розв'язання
- •Експериментальна частина
- •1. Визначення густини розчину ареометром
- •4. Визначення концентрації розчиненої речовини методом титрування
- •Контрольні питання і задачі
- •Лабораторна робота № 4 електролітична дисоціація. Реакції в розчинах електролітів. Умови утворення осаду
- •Контрольні питання і задачі
- •Лабораторна робота № 5 рН. Гідроліз солей
- •Контрольні питання і задачі
- •Лабораторна робота № 6 окисно-відновні реакції
- •Вплив середовища на перебіг реакції:
- •Контрольні питання та вправи
- •Лабораторна робота № 7 гальванічні елементи
- •Контрольні питання та вправи
- •Лабораторна робота № 8 електроліз
- •Контрольні питання і задачі
- •Рекомендована література основна
- •Додаткова
Молярні маси еквівалентів складних речовин
Молярна маса еквівалентів кислоти (МЕК) – відношення молекулярної маси кислоти до основності, яка визначається кількістю атомів Гідрогену, що беруть участь у реакції.
МЕК
=
![]() ,
(г/моль).
,
(г/моль).
Для реакції H2SO4 + 2NaOH = Na2SO4 + 2H2O МЕ(H2SO4) = М(Н2SO4)/nН = 98/2 = 49 г/моль, а для реакції H2SO4 + NaOH = NaНSO4 + H2O МЕ(H2SO4) = М(Н2SO4)/nН = 98/1 = 98 г/моль.
Молярна маса еквівалентів основи (МЕО) – відношення молекулярної маси основи до кислотності, яка визначається кількістю гідроксогруп, що вступають у реакцію:
МЕО
=
![]() ,
(г/моль).
,
(г/моль).
МЕ(Сa(OH)2) = М(Сa(OH)2)/n ОН– = 74/2 = 37 г/моль.
Молярна маса еквівалентів солі (МЕС) – відношення молекулярної маси солі до добутка кількості атомів металу, що вступають у реакцію, на їх валентність:
МЕС
=
![]() ,
(г/моль).
,
(г/моль).
МЕ(Al2(SO4)3) = М(Al2(SO4)3)/(В·n)= 342/(2·3) = 57 г/моль.
Молярна маса еквівалентів оксиду (МЕОк) знаходиться аналогічно до молярної маси еквівалентів солі або як сума молярних мас еквівалентів елемента і Оксигену:
МЕОк
=
![]() ,
(г/моль).
,
(г/моль).
МЕ(Al2O3) = (Al2O3)/(В·n)=102/(2·3) = 17 г/моль, МЕ(Al2O3) = ME(Al) + ME(O2) = (27/3) + 8 = 17 г/моль.
Для газоподібних речовин користуються молярними об'ємами еквівалентів (VЕ). VЕ(Н2) = 11,2 л/моль, VЕ(О2) = 5,6 л/моль, VЕ(Сl2) = 11,2 л/моль.
Окисний еквівалент – відношення молекулярної маси окисника до кількості електронів, що він приймає в даній окисно-відновній реакції. Відновний еквівалент – відношення молекулярної маси відновника до кількості електронів, що віддані в даній реакції.
Електрохімічний еквівалент – відношення хімічного еквівалента речовини, що виділилася на електроді, до сталої Фарадея (F).
3. Основні закони хімії
Закон збереження маси: в результаті хімічних перетворень сума мас речовин до реакції і сума мас речовин після реакції однакова.
Закон збереження енергії: будь-яка енергія не зникає і не виникає, а тільки одні її види переходять в інші.
Закон сталості складу: кожна речовина має постійний якісний і кількісний склад незалежно від способів її одержання. Речовини, що отримані різними способами, але які мають той самий якісний і кількісний склад, мають однакові хімічні властивості.
Закон кратних відношень: якщо два елементи утворюють один з одним кілька хімічних сполук, то маси одного елемента, що приходяться на ту саму масу іншого елемента, відносяться між собою як невеликі цілі числа.
Закон об'ємних відношень: об'єми взаємодіючих газоподібних речовин відносяться між собою і до об'ємів продуктів реакції, як невеликі цілі числа.
Закон Авогадро (1811 р.): у рівних об'ємах різних газів при однакових умовах міститься однакове число часток (молекул, атомів, йонів).
Наслідки: 1. Моль будь-якого газу при нормальних умовах займає об'єм 22,4 л.
2. Моль будь-якого газу за нормальних умов містить 6,02 · 1023 часток (стала Авогадро NА).
Закон еквівалентів:
1. хімічні елементи сполучаються
один з одним, а речовини реагують і
утворюються в еквівалентних кількостях.
2. Маси (об'єми) речовин, що реагують,
пропорційні молярним масам (об'ємам)
їхніх еквівалентів: