
- •Часть I. Электрохимия
- •Литература
- •1. Теоретическая часть
- •Работа № 3 потенциометрический метод определения активности ионов в растворе
- •1. Теоретическая часть
- •Если обозначить стандартный потенциал хлорсеребряного электрода, окончательно выражение для потенциала хлорсеребряного электрода принимает вид:
- •Потенциалом стеклянного электрода называется сумма всех трех скачков потенциала:
- •Окислительно-восстановительных электродов
- •1. Теоретическая часть
- •Поскольку потенциал хингидронного электрода (см. Ранее) определяется уравнением Нернста:
- •Отсюда следует, что для определения стандартного потенциала хингидронного электрода необходимо измерить значение эдс гальванического элемента при рН равном нулю:
- •Буферная система: о.1 н раствор лимонной кислоты (с6н8о7) и 0.2 н раствор Nа2нро4
Поскольку потенциал хингидронного электрода (см. Ранее) определяется уравнением Нернста:
![]() ,
,
то:
![]() .
.
Отсюда следует, что для определения стандартного потенциала хингидронного электрода необходимо измерить значение эдс гальванического элемента при рН равном нулю:
![]()
и
из нее, зная величину потенциала
хлорсеребряного электрода, вычислить
значение
![]() .
Однако измерить ЭДС непосредственно
при рН раствора равном нулю невозможно,
поскольку определить рН такого раствора
с помощью стеклянного электрода нельзя
(стеклянный электрод способен надежно
измерять кислотность растворов в
интервале рН от ~1 до ~12). Поэтому величину
.
Однако измерить ЭДС непосредственно
при рН раствора равном нулю невозможно,
поскольку определить рН такого раствора
с помощью стеклянного электрода нельзя
(стеклянный электрод способен надежно
измерять кислотность растворов в
интервале рН от ~1 до ~12). Поэтому величину
![]() определяют, измеряя несколько значений
ЭДС при рН от ~1 до ~7 (в более щелочной
среде возможна диссоциация гидрохинона),
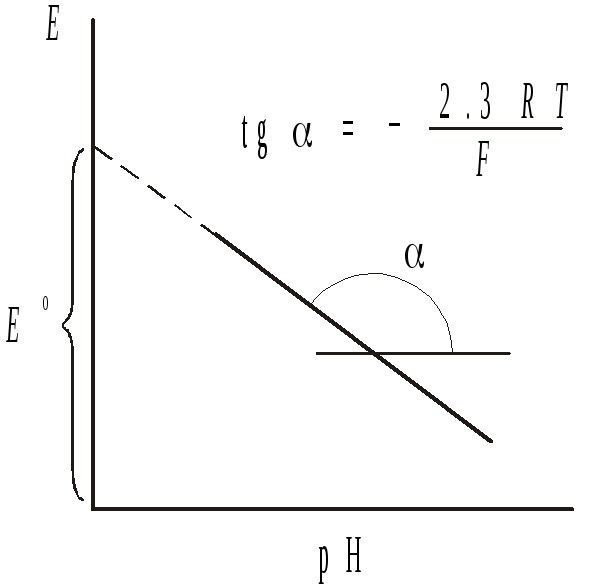
и строя зависимость E
от рН (см.
рисунок). Величина
определяют, измеряя несколько значений
ЭДС при рН от ~1 до ~7 (в более щелочной
среде возможна диссоциация гидрохинона),
и строя зависимость E
от рН (см.
рисунок). Величина
![]()
равна отсекаемому отрезку на оси ординат. Стандартный потенциал хингидронного электрода вычисляется как:
![]() .
.
3.1. Пользуясь данными табл. 2 приготовить в специально предназначенных для этого колбах семь буферных растворов с различными значениями рН в интервале от ~2 до ~7.
Таблица 2
Буферная система: о.1 н раствор лимонной кислоты (с6н8о7) и 0.2 н раствор Nа2нро4
-
рH
С6Н8О7
V, мл.
Nа2HР04
V, мл.
рH
С6Н8О7
V, мл.
Nа2HР04
V, мл.
2.6
26.7
3.3
4.9
14.9
15.1
2.7
26.0
4.0
5.0
14.6
15.4
2.8
25.3
4.7
5.1
14.3
15.7
2.9
24.6
5.4
5.2
13.9
16.1
3.0
23.9
6.1
5.3
13.6
16.4
3.1
23.3
6.7
5.4
13.3
16.7
3.2
22.6
7.4
5.5
12.9
17.1
3.3
22.0
8.0
5.6
12.6
17.4
3.4
21.5
8.5
5.7
12.2
17.8
3.5
20.9
9.1
5.8
11.9
18.1
3.6
20.3
9.7
5.9
11.5
18.5
3.7
19.9
10.1
6.0
11.1
18.9
3.8
19.4
10.6
6.1
10.6
19.4
3.9
18.9
11.1
6.2
10.2
19.8
4.0
18.5
11.5
6.3
9.7
20.3
4.1
18.0
12.0
6.4
9.2
20.8
4.2
17.6
12.4
6.5
8.7
21.3
4.3
17.0
13.0
6.6
8.2
21.8
4.4
16.5
13.5
6.7
7.5
22.5
4.5
16.0
14.0
6.8
6.8
23.2
4.6
15.5
14.5
6.9
6.0
24.0
4.7
15.3
14.7
7.0
5.3
24.7
4.8
15.2
14.8
3.2. В соответствии с инструкцией по работе с рН-метром провести измерения точных значений рН для всех приготовленных растворов, вылить их обратно в колбы, занести полученные данные в табл. 3.
3.3. Собрать гальванический элемент, соединив электролитическим мостиком хлорсеребряный электрод с платиновым электродом, помещенным в отдельный стакан емкостью 50 мл (не путать концы электролитического мостика!).
3.4. Налить в стакан с платиновым электродом 20-30 мл буферного раствора с наименьшим значением рН, добавить к нему хингидрон (одну лопаточку), дождаться установления постоянного значения ЭДС, записать его в табл. 3.
3.5. Вылить раствор в раковину, ополоснуть стакан следующим раствором с большим значением рН, провести измерение как описано в п. 3.4.
Таблица 3
-
№
п.п.
рН
рНизмер.
E, мВ
1
2
…..
7
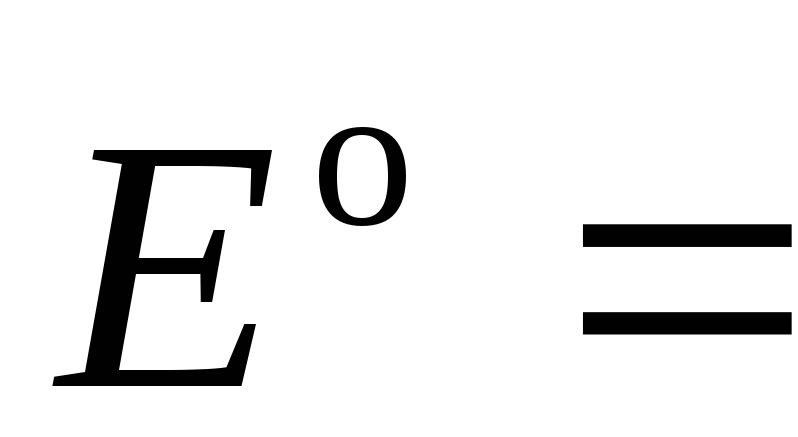
, мВ
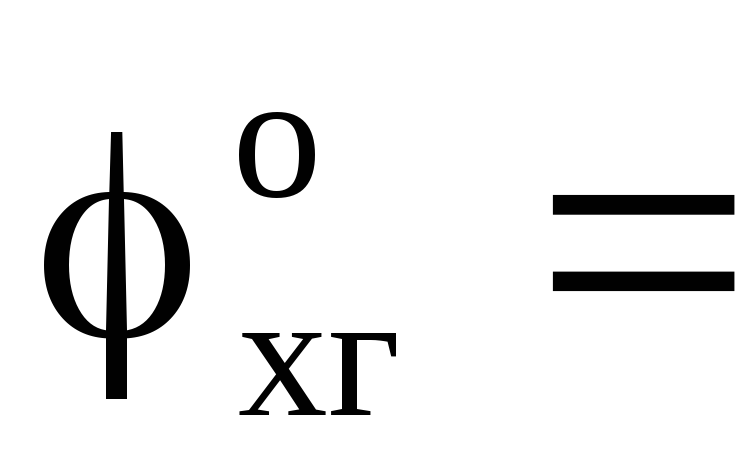
, мВ
3.6. Измерить значения ЭДС гальванического элемента с использованием всех приготовленных буферных растворов, заполнить табл. 3.
3.7. На миллиметровой
бумаге построить график зависимости
ЭДС от рН, графическим методом определить
![]() .
Вычислить
.
Вычислить
![]() ,
используя значение потенциала
хлорсеребряного электрода при температуре
опыта (см. таблицу на рабочем месте),
сравнить полученное значение с приведенным
в справочнике для 298 К.
,
используя значение потенциала
хлорсеребряного электрода при температуре
опыта (см. таблицу на рабочем месте),
сравнить полученное значение с приведенным
в справочнике для 298 К.
3.8. При оформлении отчета привести схемы гальванических элементов, использовавшихся в работе.
Контрольные вопросы к теме: "Определение электрохимических характеристик окислительно-восстановительных электродов"
1. Что такое окислительно-восстановительные электроды, в чем их отличие от электродов других типов?
2. Какие процессы протекают в окислительно-восстановительных электродах первой группы (простые электроды) и второй группы (сложные электроды)?
3. От каких параметров зависят потенциалы окислительно-восстановительных электродов?
4. Что такое стандартный окислительно-восстановительный потенциал? Как его можно определить экспериментально?
5. Как связаны окислительная активность и величина стандартного окислительно-восстановительного потенциала?
6. Зависимость константы равновесия окислительно-восстановительной реакции от стандартных окислительно-восстановительных потенциалов реагентов.
Литература
1. Физическая химия/Под ред. К.С. Краснова. -М.: Высшая школа. 1982, с.483-484.
2. Киреев В. А. Курс физической химии .-М.: Химия, 1975, с.586-589.
СОДЕРЖАНИЕ
|
|
стр. |
|
Работа № 1. ОПРЕДЕЛЕНИЕ ЧИСЕЛ ПЕРЕНОСА ИОНОВ В РАСТВОРЕ МЕТОДОМ ГИТТОРФА . |
3 |
|
Работа № 2. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА МЕТОДОМ ИЗМЕРЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ |
13 |
|
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ К РАБОТАМ № 3 и № 4 |
23 |
|
Работа № 3. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ИОНОВ В РАСТВОРЕ |
32 |
|
Работа № 4. ОПРЕДЕЛЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ХАРАКТЕРИСТИК ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ЭЛЕКТРОДОВ |
46 |
