
- •1.Строение атома. Модели строения атома. Строение атома по Бору. Представления о квантовой механике.
- •2. Химическая связь. Природа и механизм образования химической связи. Метод валентных связей.
- •4.Кинетика химических процессов. Скорость химических реакций гомо- и гетерогенных систем. Влияние различных факторов на скорость химических реакций. Основной закон кинетики и правило Вант-Гоффа.
- •5. Химическое равновесие. Обратимые и необратимые химические реакции. Химическое равновесие в газовой фазе и условия его смещения (на примере хлороводорода и аммиака). Принцип Ле Шателье.
- •6. Комплексные соединения. Координационная теория Вернера. Номенклатура. Классификация. Устойчивость комплексных соединений. Константа нестойкости.
- •8. Концентрация растворов. Способы выражения концентрации растворов.
- •14. Квантово - механическая модель атома. Атомные орбитали. Квантовые числа.
- •20. Благородные газы.
- •21. Азот и его соединения.
1.Строение атома. Модели строения атома. Строение атома по Бору. Представления о квантовой механике.
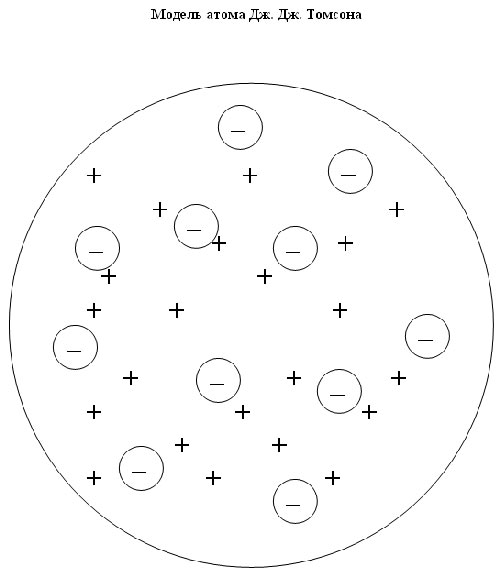
Атом - химически неделимая частица и яв-ся наименьшей частицей хим.элемента. Первые доказ-ва сложного строения атома получены при изуч процессов прохождения Эл/тока ч/з жидкости. Фарадей 30г 19в – электричество существует в виде отдельных единичных зарядов. Прямым док-вом сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов- радиоактивность (Беккерель). Последовавшие за этим установление природы α, β γ - лучей, образующихся при радиоактивном распаде (Резерфорд, 1899-1903), открытие ядер атомов (Резерфорд, 1909-1911), открытие электрона (Томсон, 1897), определение заряда электрона (Милликен, 1909). Томсон 1904г. модель атома, к этому времени было известно об атоме: 1. атомы имеют сложную стр-ру; 2. одно из составных частей атомы электроны, несущие отриц заряд; 3. атомы содержат частицы, несущие положит заряд равен сумме отриц зарядов. Положит заряжен шар с электронами, распол строго по окружности.
 «сливовый
пудинг»
«сливовый
пудинг»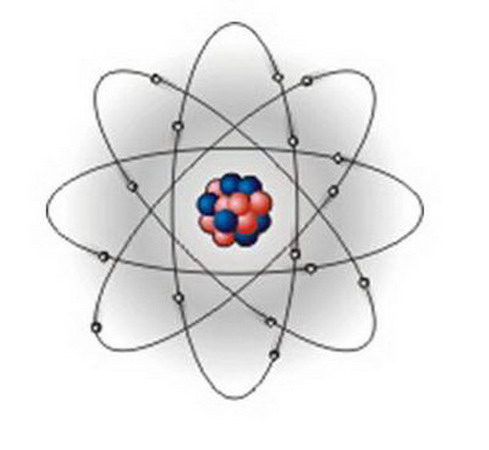 «планетарный»
«планетарный»
1910 Резерфорд предложил планетарную модель атома: 1. В центре атома существует «+» заряженное ядро, занимающее ничтожную часть пространства внутри атома; 2. весь «+» заряд и вся масса атома сосредоточены в его ядре; 3. вокруг ядра вращаются электроны, их число равно «+» заряду ядра. Недостаток: 1. не объяснил причину устойчивости атомов (почему атомы устойчивы и не падают на ядро); 2. не объяснил почему спектры линейные.
На смену его модели приходит модель Бора (1913г). Основана на 2х постулатах: 1. электрон может вращаться вокруг ядра не по произвольным, а строго по (стационарным) круговым орбитам. При движении по стационарным орбитам электрон не излучает и не поглощает энергии. Т.о. Бор предложил, что электрон в атоме не подчиняется законам классической физики. По Бору, излучение или поглощение энергии опред-ся переходом из одного состояния с энергией Е1 в другое Е2, что соответ переходу электрона с одной стационарной орбиты на другую. ΔЕ=Е1-Е2=hν, ν- частота излучения, h-постоянна Планка. Атом водорода имеет минимальную энергию, когда электрон нах-ся на 1 орбите. Такое состояние наз-ся основным- атом имеет миним энергию. При переходе электрона на более высокие орбиты атом стан-ся возбужденным, это состояние атома не устойчиво. Модель атома Бора характерна только для водорода. Недостаток модели Бора: непригодность для многоэлектронных атомов. Теорию Бора сменила квантовая теория, к-рая учитывает волновые свойства электрона и др элементарных частиц.
Квантовая механика – это наука о строении и св-ах элементарных частиц, ядер, атомов и молекул,об их превращениях и явлениях, сопровож-их эти превращения.
Основные положения современной теории:
1. электрон имеет двойственную (корпускулярно- волновую) природу. Он м. вести себя и как частица, и как волна: подобно частице, электрон обладает опред массой и зарядом, и движущийся электрон проявляет волновые свойства (способность к дифракции). Длина волны электрона λ и его скорость υ связаны соотношением де Бройля (1924): λ=h|mυ, m- масса электрона, λ- длина волны, υ- скорость электрона, h- пост Планка.
2. для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот.
3. электрон в атоме не движется по опред траекториям, а может нах-ся в любой части около ядерного пространства. Пространство вокруг ядра, в к-ром вероятность нахождения электрона достаточно велика наз-ся орбиталью.
4. ядра атомов состоят из протонов и нейтронов(нуклоны). Число протонов в ядре равно порядковому номеру элемента в ПС, а сумма чисел протонов и нейтронов соответствует его массовому числу. Это было сформулировано после открытия в 1920г Резерфордом протона, и 1932г Чедвиком- нейтрона.
Различные виды атомов имеют общее название- нуклиды: А- массовое число, Z- заряд ядра, равен числу протонов, N- число нейтронов в ядре. Z= A-N. N= A-Z, A= Z+N, НУКЛИДЫ С ОДИНАКОВЫМ Z, но различными A и N наз-ся изотопами.
Вся совокупность сложных движений электрона в атоме описывается 5 квантовыми числами: главным n, побочным l, магнитным ml, спиновым s и проекцией спина ms
1. главное квантовое число- хар-ет энергет уровни электрона в Эл/магнитном поле ядра, n- номер энергет уровня, принимает любые целые значения от 1 до ∞, исключая 0.
2. орбитальное – хар-ет форму Эл/орбиталей, приним все значения от 0 до n-1. орбитальное квант число обознач лат строчными буквами s,p,d,f. 0-s орбиталь (шар), l=1 (p-орбиталь- гантеля), и др.
3. магнитное- хар-ет пространственную ориентацию Эл/облаков , относительно др друга может принимать любве целые численные значения от - ∞ до + ∞, включая 0.
4. спиновое – хар-ет движение электрона вокруг собственной оси . имеет всего 2 значения: -1/2 и + ½. S- состояние м.б.не более 2℮, p- 6℮, d-10℮, f-14℮.
Принципы и правила заполнения Эл/оболочек орбиталей:
1. Принцип наименьшей энергии- в атоме каждый электрон располагается так, чтобы его энергия была минимальной.
2. Правило Клечковского- атомные орбитали заполн по возрастанию суммы квантовых чисел n+l, а при одинаковых значениях сумма по возрастанию главного квантового числа.
3. Принцип Паули (1925)- в атоме не м.б. 2х электронов, у к-рых все 4 квантовых числа были бы одинаковы.
4. Правило Хунда- в пределах опред подуровня электроны располагаются т.о., чтобы суммарный спин был максимальным.
