
- •1.Методы физического исследования: опыт ,гипотеза, эксперимент, теория
- •4.Физические модели:материал.Точка, твердое тело,пространство и время и со и ск
- •5.Кинематические характеристики мех движ.Их опр и выч на примере м1
- •14.Система мат точек .Внешние и внутр силы
- •20.. Закон сохранения энергии в механике. Примеры.
- •38Распределение частиц по скоростям. Распределение Масквела
- •40Газовые законы и их изображение в 3 коар
38Распределение частиц по скоростям. Распределение Масквела
В
газе молекулы при соударении обмениваются
скоростями случайным образом, в результате
огромного числа соударений устанавливается
стационарное состояние, когда число
молекул в заданном интервале скоростей
сохраняются постоянными (с точностью
до флуктуации). Квадратичная скорость
молекул массой
![]() остается постоянной и равной:
остается постоянной и равной:
![]() .
.
Если
разбить диапазон скоростей молекул на
малые интервалы, равные
![]() ,
то на каждый интервал скорости будет
приходиться некоторое число молекул
,
то на каждый интервал скорости будет
приходиться некоторое число молекул
![]() ,
имеющих скорость заключенных в этом
интервале. Функция
,
имеющих скорость заключенных в этом
интервале. Функция
![]() определяет относительное число молекул
определяет относительное число молекул
![]() ,
скорости которых лежат в интервале от
,
скорости которых лежат в интервале от
![]() до
до
![]() ,
т. е.
,
т. е.
![]() .
.
П![]() рименяя
методы теории вероятностей, Максвелл
нашел функцию
рименяя
методы теории вероятностей, Максвелл
нашел функцию
![]() −
закон
распределения молекул идеального газа
по скоростям:
−
закон
распределения молекул идеального газа
по скоростям:![]() .
Средняя скорость молекулы
.
Средняя скорость молекулы
![]() определяется по формуле:
определяется по формуле:
.Скорости, характеризующие состояние газа:
верояная![]() ;
2. средняя
;
2. средняя
![]() ;
;
3.
средняя квадратичная
![]() .
.
39.Распределение
Больцмана. Барометрическая формула
Распределение
Больцмана:
молекулы любого газа находятся в
потенциальном поле тяготения Земли.
Тяготение и тепловое движение молекул
приводят к некоторому стационарному
состоянию газа, при котором давление
газа с высотой убывает. Больцман обобщил
распределение Максвелла на случай
поведения частиц в произвольном силовом
поле.![]() − распределение
Больцмана во внешнем потенциальном
поле.
− распределение
Больцмана во внешнем потенциальном
поле.
40Газовые законы и их изображение в 3 коар
Начнем
с рассмотрения изохорного
процесса
(V=
const).
На рисунке показаны процессы изохорного
нагревания (прямая /—2)
и
охлаждения (прямая /—3).
Практически
изохорный процесс осуществляется при
изменении температуры газа, находящегося
в толстостенном сосуде V
= const.
В изохорном процессе газ не совершает
работы:
![]() А
=р dV
= 0. По первому началу термодинамики вся
теплота, сообщаемая газу в изохорном
процессе, идет на изменение его внутренней
энергии:
А
=р dV
= 0. По первому началу термодинамики вся
теплота, сообщаемая газу в изохорном
процессе, идет на изменение его внутренней
энергии:
![]() , т. е.
, т. е.
![]() ,
,![]()
,
![]() Изобарный
процесс
(p
= const).
Практически он осуществляется, например,
при нагревании или охлаждении газа,
находящегося в цилиндре с подвижным
поршнем, на который действует
постоянное внешнее давление.
Изобарный
процесс
(p
= const).
Практически он осуществляется, например,
при нагревании или охлаждении газа,
находящегося в цилиндре с подвижным
поршнем, на который действует
постоянное внешнее давление.
![]() ,
,![]()
![]() Изотермический процесс (кипение,
конденсация, плавление и кристаллизация
химически чистых веществ, происходящие
при
Изотермический процесс (кипение,
конденсация, плавление и кристаллизация
химически чистых веществ, происходящие
при![]() )
изменения V
газа может происходить в условиях,
когда теплообмен между газом и внешней
средой осуществляется при
)
изменения V
газа может происходить в условиях,
когда теплообмен между газом и внешней
средой осуществляется при
![]() .
.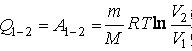 Адиабатный процесс
происходит при Q
= 0.
Это может
быть обеспечено хорошей теплоизоляцией
газа. Примеры
адиабатных процессов –
сжатия воздуха в цилиндре воздушного
огнива, в цилиндре двигателя внутреннего
сгорания. В соответствии с первым
законом термодинамики, при адиабатном
сжатии изменение внутренней энергии
газа
Адиабатный процесс
происходит при Q
= 0.
Это может
быть обеспечено хорошей теплоизоляцией
газа. Примеры
адиабатных процессов –
сжатия воздуха в цилиндре воздушного
огнива, в цилиндре двигателя внутреннего
сгорания. В соответствии с первым
законом термодинамики, при адиабатном
сжатии изменение внутренней энергии
газа
![]() равно работе внешних сил А.
равно работе внешних сил А.
41Теплоемкость
идеального газа. Адиабат процесс. Ур-ие
Майера
теплоемкость-величина =количеству тепла
, которое нужно сообщить телу чтобы
повысить его темпер на один кельвин
Дж/К
Адиабатный процесс
происходит при Q
= 0.
Это может
быть обеспечено хорошей теплоизоляцией
газа. Примеры
адиабатных процессов –
сжатия воздуха в цилиндре воздушного
огнива, в цилиндре двигателя внутреннего
сгорания. В соответствии с первым
законом термодинамики, при адиабатном
сжатии изменение внутренней энергии
газа
![]() равно работе внешних сил А.
равно работе внешних сил А.
[ Cp=((i+2)/2)*R],Cv=(i/2)*R, Cp>Cv, Cp-Cv=R
42Первое начало термодинамики и его применение к изорпроцессам1 зак.: невозможен вечный двигатель первого рода, т.е. такой периодически действующий двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энергия.
Начнем
с рассмотрения изохорного
процесса
(V=
const).
На рисунке показаны процессы изохорного
нагревания (прямая /—2)
и
охлаждения (прямая /—3).
Практически
изохорный процесс осуществляется при
изменении температуры газа, находящегося
в толстостенном сосуде V
= const.
В изохорном процессе газ не совершает
работы:
![]() А
=р dV
= 0. По первому началу термодинамики вся
теплота, сообщаемая газу в изохорном
процессе, идет на изменение его внутренней
энергии:
А
=р dV
= 0. По первому началу термодинамики вся
теплота, сообщаемая газу в изохорном
процессе, идет на изменение его внутренней
энергии:
![]() ,
т. е.
,
т. е.
![]() ,
,
![]() ,
,
![]() Изобарный
процесс
(p
= const).
Практически он осуществляется, например,
при нагревании или охлаждении газа,
находящегося в цилиндре с подвижным
поршнем, на который действует
постоянное внешнее давление.
Изобарный
процесс
(p
= const).
Практически он осуществляется, например,
при нагревании или охлаждении газа,
находящегося в цилиндре с подвижным
поршнем, на который действует
постоянное внешнее давление.
![]() ,
,![]()
![]() Изотермический процесс (кипение,
конденсация, плавление и кристаллизация
химически чистых веществ, происходящие
при
Изотермический процесс (кипение,
конденсация, плавление и кристаллизация
химически чистых веществ, происходящие
при![]() )
изменения V
газа может происходить в условиях,
когда теплообмен между газом и внешней
средой осуществляется при
)
изменения V
газа может происходить в условиях,
когда теплообмен между газом и внешней
средой осуществляется при
![]() .
.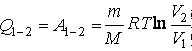 Адиабатный процесс
происходит при Q
= 0.
Это может
быть обеспечено хорошей теплоизоляцией
газа. Примеры
адиабатных процессов –
сжатия воздуха в цилиндре воздушного
огнива, в цилиндре двигателя внутреннего
сгорания. В соответствии с первым
законом термодинамики, при адиабатном
сжатии изменение внутренней энергии
газа
Адиабатный процесс
происходит при Q
= 0.
Это может
быть обеспечено хорошей теплоизоляцией
газа. Примеры
адиабатных процессов –
сжатия воздуха в цилиндре воздушного
огнива, в цилиндре двигателя внутреннего
сгорания. В соответствии с первым
законом термодинамики, при адиабатном
сжатии изменение внутренней энергии
газа
![]() равно работе внешних сил А.
равно работе внешних сил А.
43.Обратимые и необратимые процессы обратимые-если в результате какго-нибудь процесса система переходит из одного состояния в другие и существует возможность ее возврата в исходное состаяние таким образом, что во всех материальных объектах, окруж эту систему не происходит никаких изменений Необратимые-если после его завершения систему нельзя вернуть в исходное состояние так чтобыс мат объектами окружающими ее не произошло никаких изменений. Все процессы теплообмена между телами термодин системы , температура которыхнеодинакова, явл необратимыми.
44Энтропия
.Второе начало термодинамики
Пусть
![]() — элементарное количество теплоты,
сообщаемое нагревателем системе при
малом изменении ее состояния, а
Т – температура
нагревателя. Если процесс обратимый,
то
температура системы тоже равна Т.
Можно
показать, что в отличие от
— элементарное количество теплоты,
сообщаемое нагревателем системе при
малом изменении ее состояния, а
Т – температура
нагревателя. Если процесс обратимый,
то
температура системы тоже равна Т.
Можно
показать, что в отличие от
![]() отношение
отношение
![]() в обратимом процессе – полный дифференциал
функции состояния системы, называемой
энтропией
S
системы:
в обратимом процессе – полный дифференциал
функции состояния системы, называемой
энтропией
S
системы:![]() .
Таким
образом, в обратимом процессе температура
Т
является
интегрирующим делителем, который
обращает элементарную теплоту
.
Таким
образом, в обратимом процессе температура
Т
является
интегрирующим делителем, который
обращает элементарную теплоту
![]() в полный дифференциал dS.
Если
процесс круговой, то для и.г. справедливо
тождество:
в полный дифференциал dS.
Если
процесс круговой, то для и.г. справедливо
тождество:![]() .
При
нагревании тела
.
При
нагревании тела
![]() и его энтропия возрастает (dS
> 0),
при охлаждении
и его энтропия возрастает (dS
> 0),
при охлаждении
![]() и энтропия тела убывает (dS
< 0).
В обратимом адиабатном процессе
и энтропия тела убывает (dS
< 0).
В обратимом адиабатном процессе
![]() =
Т dS
= 0,
так что dS
= 0
и
=
Т dS
= 0,
так что dS
= 0
и
![]() .
Таким образом, обратимый адиабатный
процесс представляет собой
изоэнтропийный
процесс.
2зак.:Неосуществим
термодинамический процесс, в результате
которого происходила бы передача
тепла от одного тела к другому, более
горячему, без каких-либо других изменений
в природе.
.
Таким образом, обратимый адиабатный
процесс представляет собой
изоэнтропийный
процесс.
2зак.:Неосуществим
термодинамический процесс, в результате
которого происходила бы передача
тепла от одного тела к другому, более
горячему, без каких-либо других изменений
в природе.
Невозможно построить периодически действующую машину, которая непрерывно превращала бы теплоту в работу только за счет охлаждения одного тела, без того чтобы в окружающих телах не произошло одновременно каких-либо изменений.
45Круговые цыклы .КПД Круговые процессы (циклы) – такая совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние.
Круговые процессы лежат в основе всех тепловых машин — двигателей внутреннего сгорания, паровых турбин, холодильных машин и др.
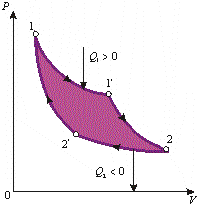
Рассмотрим
обратимый круговой процесс, впервые
изученный С. Карно (1824) и потому называемый
циклом
Карно.
Он
состоит из четырех обратимых процессов:
двух изотермических и двух адиабатныхРабота
A,
совершаемая за прямой цикл, всегда
меньше количества теплоты Qподв,
подводимого к рабочему телу всеми
нагревателями (справедливо для всех
прямых круговых процессов). Термический
коэффициент полезного действия цикла:
![]() .
.
Максимальный
КПД тепловой машины.
Независимо
от конструкции и выбора рабочего
тела max
значение КПД тепловой машины
определяется выражением:
![]() .
.
Любая
реальная тепловая машина может иметь
КПД, не превышающий это max
значение:
![]() .
существует два пути — повышение
температуры Т1
нагревателя
и понижение температуры Т2
холодильника.
.
существует два пути — повышение
температуры Т1
нагревателя
и понижение температуры Т2
холодильника.
47.Диффузия.Коэфф диффузии.Дифф в газахДиффузия-явление проникновения молекул одного вещества в межмрлекулярные промежутки другого. Д-коэф диффузии самый главный параметр
D=1/3(v)![]() в газах-перенос
малекул т.е. выравнивание канц молекул
разного сорта взаимное проникновение
молекул 1-го сорта в среду2
в газах-перенос
малекул т.е. выравнивание канц молекул
разного сорта взаимное проникновение
молекул 1-го сорта в среду2
48.Теплопроводность. Коэф. теплопров.теплопров-непосредственный обме энергией между хаотически движущимися частицами взаимодейств. тел или частей одного и того же тела.
49 Вязкость. вязкость газов вязк-внутрение трение,вязк газов зависит от хим.состава, примесей,и температуры
50.Фазы и фаз превращения фаза-термодин равновесноесостояние вещества которое отлич своими физ cвойствами от других возможных равнов фазовых состояний данного вещетва.термодин равнов означает , что данное вещество нах в таком состаянии ,что количество тепла получ и отдав равно. Под фазовым превращением понимают переходы из одного состояния в 2-ое.любой фазовый переход сопровождается поглащением или отдачей энергии,при неизменном внешнем условии т.е. состоянии равновесия при постоянной температуре
