
- •Степень электролитической диссоциации
- •Сильные и слабые электролиты
- •Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
- •1.4 Схема электролитической диссоциации электролита с ковалентными связями, роль воды в этом процессе.
- •1.5 Определение водородного показателя. Его математическая выражение, какая реакция среды возникает при различных уровнях значения рН
- •1.7 Общее определение реакций нейтрализации и гидролиза, в каких случаях эти реакции протекают обратимо или необратимо
- •Гидролиз солей
- •Степень гидролиза
- •Константа гидролиза
- •Соли, образованные сильным основанием и сильной кислотой
- •Соли, образованные слабым основанием и сильной кислотой
- •Соль, образованная сильным основанием и слабой кислотой
- •Соли, образованные слабым основанием и слабой кислотой
- •Влияние различных факторов на протекание гидролиза
- •2.Тема овр.
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •2.2 Дайте определение следующим понятиям: окислени, восстановление, окислитель , восстановитель.
- •2.3 Дайте определение понятия степень окисления и укажите, каким способом и с какой целью ее определяют для элементов, входящих в состав химического соединения.
- •Расчет степени окисления
- •2.4 Объясните, какая зависимость существует между ов спсобностью химического элемента и его металличностью (неметаличностью, электроотрицательностью и величиной его степени окисления)
- •2.5 Как определяется возможная роль в овр химического элемента или атома в составе молекулы (только окислитель, только восстановитель, окислительно-восстановительная двойственность)
- •Внутримолекулярные окислительно- восстановительные реакции
- •3.Тема Электрохимические системы, электродные потенциалы и химические источники электрического тока
- •3.3 Дайте определение понятия равновесный электродный потенциал ; приведите схему и условия его образования
- •3.6 Опишите устройство и принцип действия биметаллических гальванических элементов ну и тд.Эдс расчет пример. Гальванические элементы. Направление окислительно-восстановительных реакций
- •4 .Тема Реакции окисления металлов
- •4.1 Укажите какую роль в овр могут играть атомы металлов и объясните почему. Перечислите класс(разновидность) веществ, способных выступать в роли окислителей металлов
- •4.2 Какое явление называется пассивацией металлов; объясните что является его причиной и при каких условиях она возможна.
- •Пассивация[править | править вики-текст]
- •4.3 Объясните по какому признаку кислоты в реакциях с металлами делятся на кислоты-окислители и кислоты-неокислители; приведите примеры кислот обоих разновидностей и их реакций с металлами
- •5 Тема Способы выражения концентрации раствора
- •5.2 Дайте определения моля вещества, эквивалента элемента, простого вещества , эквивалента сложного вещества. Приведите по одному конкретному примеру для расчета этих величин.
- •6 Тема Физико-химические свойства растворов неэлектролитов
- •7 Тема. Органические соединения. Http://orgchem.Tsu.Ru/1stroenie.Htm Если чего не хватает!!!!!
- •7.1 Изложите основные положения теории строения химических соединений Бутлерова.
- •7.2 Дайте общую классификацию соединений на ряды ( по строению углеродной цепи) и классы. Классификация органических соединений
- •7.3 Дайте определение следующих понятий: Углеводороды, Производные углеводородов, Полифункциональные соединения.
- •Гомологический ряд
- •Изомерия углеродной цепи (углеродного скелета)[
- •5. Пространственная изомерия
- •6. Оптическая изомерия
- •I. Классификация по механизму реакции
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •7.7 Опишите сущность индуктивного и мезомерного электронных эффектов в молекулах органических соединений. Индуктивный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •Мезомерный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •7.8 Охарактеризуйте сущность явления пи/пи и p/пи- сопряжения в молекулах органических соединений.
- •7.9 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алканов. Укажите направления их использования.
- •Реакции радикального замещения Галогенирование
- •Сульфохлорирование (реакция Рида
- •Нитрование
- •Реакции окисления
- •Термические превращения алканов
- •Конверсия метана
- •Реакции электрофильного замещения
- •7.10 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкенов. Укажите направления их использования.
- •Электронное строение двойной связи
- •Химические свойства[править | править вики-текст]
- •Реакции электрофильного присоединения[править | править вики-текст]
- •Галогенирование[править | править вики-текст]
- •Гидрогалогенирование[править | править вики-текст]
- •Гидроборирование[править | править вики-текст]
- •Гидратация[править | править вики-текст]
- •Алкилирование[править | править вики-текст]
- •Прочие реакции электрофильного присоединения[править | править вики-текст]
- •Реакции радикального присоединения[править | править вики-текст]
- •Реакции присоединения карбенов[править | править вики-текст]
- •Гидрирование (реакция Сабатье-Сандеран)[править | править вики-текст]
- •Реакции радикального замещения[править | править вики-текст]
- •Окисление[править | править вики-текст]
- •Окисление неорганическими окислителями[править | править вики-текст]
- •Окисление в присутствии солей палладия[править | править вики-текст]
- •Эпоксидирование[править | править вики-текст]
- •Озонолиз[править | править вики-текст]
- •Реакция карбонилирования
- •Реакции полимеризации
- •7.11 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкинов. Укажите направления их использования
- •7.12 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) аренов. Укажите направления их использования
- •Изомерия
- •Химические свойства
- •Электрофильное замещение в бензоле
Пассивация[править | править вики-текст]
Пассивация — это явление снижения скорости газовой коррозии при понижении парциального давления. Пассивация возникает из-за образования на поверхности металла (Cu, Ti, Zn, Cr, Al и т. д.) пленки.
Перепассивация — это нарушение пассивного состояния. Возникает при повышении парциального давления выше критического.
Перепассивация встречается в таких марках сталей как: 08Х18Н10Т, 20Х13, 30Х13, 40Х13, 15Х17
4.3 Объясните по какому признаку кислоты в реакциях с металлами делятся на кислоты-окислители и кислоты-неокислители; приведите примеры кислот обоих разновидностей и их реакций с металлами
![]()
Существует деление кислот на кислоты-окислители (HNO3 и конц. H2SO4) и кислоты-неокислители (все остальные). В реакциях кислот-окислителей с металлами с.о. изменяет атом элемента, образующий кислоту (азот N или сера S), а в реакциях кислот-неокислителей – атом водорода H.

Металлы, стоящие в ряду напряжений до Н2, взаимодействуют с растворами кислот-неокислителей, образуя Н2 и соли металлов с атомами в низших с.о., например:
Fe
+ H2SO4 (разб.)
= FeSO4 +
H2![]() .
.
Kислоты-окислители в водных растворах вступают в реакции практически со всеми металлами, при этом образуются соли металлов с атомами в высших с.о., H2O и продукты восстановления кислоты (не Н2). Вид этого продукта определяется концентрацией кислоты, активностью металла и температурой. В некоторых условиях реакция идет преимущественно по одному пути, и тогда ее можно описать одним уравнением, однако часто образуется смесь продуктов восстановления кислоты, и тогда возможно написание разных вариантов уравнений.

Kонцентрированная H2SO4 с большинством металлов взаимодействует только при нагревании, образуя соль, воду и SO2, например:
Cu
+ 2H2SO4 (конц.) ![]() CuSO4 +
SO2
CuSO4 +
SO2![]() +
2H2O,
+
2H2O,
2Al
+ 6H2SO4 (конц.) ![]() Al2(SO4)3 +
3SO2
Al2(SO4)3 +
3SO2![]() +
6H2O.
+
6H2O.
Щелочные и щелочно-земельные металлы, а также Mg и Zn в зависимости от условий могут восстанавливать H2SO4 (конц.) не только до SO2, но и до S или H2S, например:


Kонцентрированная HNO3 со щелочными и щелочно-земельными металлами образует соль, воду и N2O. С другими металлами – соль, воду и NO2, например:
4Ba
+ 10HNO3 (конц.)
=
4Ba(NO3)2 +
N2O![]() +
5H2O,
+
5H2O,
Ag
+ 2HNO3 (конц.)
=
AgNO3 +
NO2![]() +
H2O.
+
H2O.
С Fe, Co, Ni, Cr и Al HNO3 (конц.) взаимодействует только при нагревании, т.к. при обычных условиях эти металлы азотной кислотой пассивируются – становятся химически стойкими.
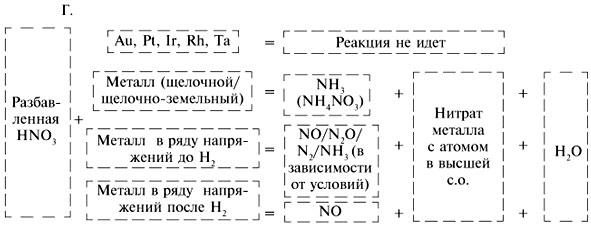
Разбавленная HNO3 со щелочными и щелочно-земельными металлами образует соль, воду и NH3, который с избытком азотной кислоты превращается в NH4NO3, например:
4Ca + 10HNO3 (разб.) = 4Сa(NO3)2 + NH4NO3 + 3H2O.
С остальными металлами, стоящими в ряду напряжений до водорода, HNO3 (разб.) образует соль, воду и в основном NO, но может в зависимости от условий давать и N2O, и N2, и NH3/NH4NO3(чем больше разбавлена кислота, тем ниже с.о. атома азота в выделяющемся газообразном продукте), например:
3Zn
+ 8HNO3 (разб.)
= 3Zn(NO3)2 +
2NO![]() +
4H2O,
+
4H2O,
4Zn
+ 10HNO3 (разб.)
= 4Zn(NO3)2 +
N2O![]() +
5H2O,
+
5H2O,
5Zn
+ 12HNO3 (разб.)
= 5Zn(NO3)2 +
N2![]() +
6H2O,
+
6H2O,
4Zn + 10HNO3 (оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O.
С малоактивными металлами, стоящими в ряду напряжений после Н2, HNO3 (разб.) образует соль, воду и NO, например:
3Cu
+ 8HNO3 (разб.)
= 3Сu(NO3)2 +
2NO![]() +
4H2O.
+
4H2O.
Очень пассивные металлы (Au, Pt) могут быть растворены царской водкой – смесью одного объема HNO3 (конц.) с тремя объемами HCl (конц.). Окислителем в ней является атомарный хлор, отщепляющийся от хлорида нитрозила, который образуется в результате реакции:
HNO3 + 3HCl = 2H2O + NOCl + Cl2.
