
- •2.Стехиометрические законы химии
- •3.Скорость химических реакций
- •4.Зависимость скорости от температуры. Понятие об энергии активации. Катализ.
- •5.Химическое равновесие
- •6.Тепловые эффекты химических реакций. Энтальпия. Закон Гесса.
- •7.Энтропия. Свободная энергия Гиббса. Термодинамический критерий направленности химического процесса.
- •8.Растворение как физико-химический процесс. Химическая теория растворов Менделеева.
- •9.Концентрация растворов. Растворимость, насыщенные и ненасыщенные растворы.
- •10.Идеальные растворы
- •11.Электролиты и неэлектролиты. Электролитическая диссоциация
- •12.Степень электролитической диссоциации
- •13.Ионное произведение воды
- •14.Кислотно-основные свойства веществ. Кислоты, основания и соли с точки зрения теории элд
- •15.Обменные реакции между ионами
- •16.Гидролиз солей
- •17.Электронная теория окисления-восстановления
- •18.Электродные потенциалы. Гальванический элемент
- •19.Электролиз расплавов и растворов
- •20.Электронное строение атома, электронные формулы и квантовые ячейки.
- •21.Квантовые числа. Принцип Паули, принцип наименьшей энергии, правило Гунда
- •22.Ковалентная связь
- •23.Понятие о гибридизации связей. Кратные связи. Поляризация ковалентной связи. Электроотрицательность
- •24.Метод молекулярных орбиталей
- •25.Ионная связь как одна из составляющих реальной химической связи
- •26.Межмолекулярное взаимодействие
13.Ионное произведение воды
Чистая
вода очень плохо проводит электрический
ток, но все же обладает измеримой
электрической проводимостью, которая
объясняется небольшой самодиссоциацией
воды на катионы водорода и гидроксид-анионы
Н2О=Н+
+ ОН-.
Константа ионизации воды
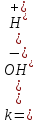 .
Так как вода – очень слабый электролит,
то концентрация недиссоциированных
молекул может быть принята равной общему
количеству молей в 1л воды [H2O]=1000/18=55,56
моль/л. Тогда k[H2O]=[Н+]
[ОН-]
или [Н+]
[ОН-]=1,8∙10-16
∙
55,56=10-14.
Величина [Н+]
[ОН-]=10-14
называется
ионным произведением воды.
.
Так как вода – очень слабый электролит,
то концентрация недиссоциированных
молекул может быть принята равной общему
количеству молей в 1л воды [H2O]=1000/18=55,56
моль/л. Тогда k[H2O]=[Н+]
[ОН-]
или [Н+]
[ОН-]=1,8∙10-16
∙
55,56=10-14.
Величина [Н+]
[ОН-]=10-14
называется
ионным произведением воды.
Важность этой величины (ионного произведения воды) состоит в том, что она сохраняет свою величину (является однозначной) для водных растворов любых веществ.
При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид-ионов, поскольку при данной температуре (22°С) ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная картина. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [Н+]>10-7, в щелочных [Н+]<10-7, в нейтральных [Н+]=10-7.
Концентрация водородных ионов и водородный показатель
водородный
показатель рН – это отрицательный
десятичный логарифм концентрации
водородных ионов.
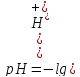 .
Тогда для нейтральной среды
.
Тогда для нейтральной среды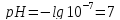 ,
для кислых растворов рН<7, для щелочных
рН>7.
,
для кислых растворов рН<7, для щелочных
рН>7.
14.Кислотно-основные свойства веществ. Кислоты, основания и соли с точки зрения теории элд
Со времен Аррениуса, по определению которогокислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоурии электронная теорияЛьюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон.
Любой кислоте соответствует сопряженное с ней основание.
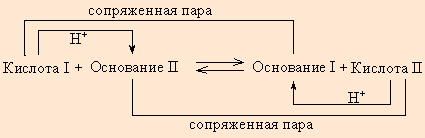
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
![]()
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
![]() концентрация ионов
H+ этого
раствора будет определяться соотношением
концентраций кислоты и соли, взятых для
его приготовления.
концентрация ионов
H+ этого
раствора будет определяться соотношением
концентраций кислоты и соли, взятых для
его приготовления.
Амфолиты
Амфотерные электролиты (амфолиты) – это вещества, которые одновременно могут проявлять и кислотные, и основные свойства.
К амфотерным относятся две группы веществ:
1. вещества, у которых и кислотные, и основные свойства определяются одной и той же функциональной группой – ОН. К таким веществам можно отнести Zn(OH)2, Al(OH)3:
2. вещества, у которых кислотные и основные свойства определяются наличием разных функциональных групп. К таким вещества относятся аминокислоты типа NH2RCOOH. В водных растворах жирные аминокислоты полностью или частично переходят в форму: NH3+RCOO- - это ион, несущий одновременно и положительный и отрицательный заряд.
