
- •Хімія води та мікробіологія вправи і методичні вказівки до їх виконання
- •Контрольні розрахунки при здійсненні аналізу води
- •1.2. Контроль результатів хімічного аналізу води.
- •1.2.2. Загальний контроль аналізу за щільним залишком
- •1.2.3. Частковий контроль аналізу за результатами окремих визначень
- •2. Оцінка якості води
- •Нормативи для питної води
- •3. Контроль процесів обробки води задачi
- •Додаток Молярні маси деяких хімічних елементів
Хімія води та мікробіологія вправи і методичні вказівки до їх виконання
Контрольні розрахунки при здійсненні аналізу води
Якщо маси двох елементів реагують без залишку з однаковою масою третього елемента, вони можуть без залишку реагувати і між собою. Так формулюється закон еквівалентів.
Еквівалентом називають кількість речовини в молях, яка реагує з одним молем атомів водню або заміщує таку саму кількість атомів водню в хімічних реакціях.
Маса еквівалента, виражена в грамах на моль, кількісно дорівнює еквіваленту речовини і називається молярною масою еквівалента М(1/ Z*Х).
Число Z* називається числом еквівалентності. Якщо Z*=1, то молярна маса еквівалента речовини дорівнює молярній масі цієї речовини: М(1/Z*Х) = M(X). Так, молярна маса еквівалента соляної кислоти та її молярна маса рівні між собою і дорівнюють М(HCl) = 36.461 г/моль.
Молярна маса еквівалента
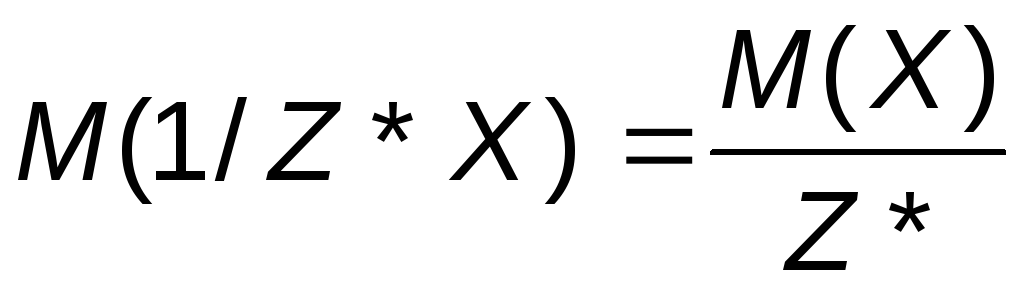 .
.
Число еквівалентності Z* залежить від виду речовини. Далі наведені правила знаходження молярної маси еквівалента.
Молярна маса еквівалента елемента M(1/ Z*Х)E дорівнює молярній масі елемента М(Х)Е, поділеній на його валентність ВЕ в даній хімічній сполуці
![]() .
.
Молярна маса еквівалента іона М(1/Z*X)І дорівнює молярній масі іона М(Х)І , поділеній на абсолютну величину його заряду nI
![]() .
.
Молярна маса еквівалента гідроксиду M(1/Z*X)Г дорівнює його молярній масі М(Х)Г , поділеній на валентність металу ВМ
![]()
![]() .
.
Молярна маса еквівалента кислоти M(1/Z*X)K дорівнює молярній масі кислоти М(Х)К ,поділеній на її основність ОК. Основність кислоти визначається кількістю атомів водню в її молекулі
![]() .
.
Молярна маса еквівалента солі М(1/ Z*Х)С дорівнює молярній масі солі М(Х)С , поділеній на добуток числа іонів металу КМ на його валентність ВМ
![]() .
.
Наведемо найбільш уживані в хімії способи вираження вмісту розчиненої речовини у розчині.
Масова частка С(і) – відношення маси розчиненої речовини до загальної маси розчину; виражається, як правило, у відсотках і показує, скільки грамів розчиненої речовини міститься в 100 г розчину. Таким чином, якщо масова частка NaOH у розчині становить 5%, це означає, що в 100 г розчину міститься 5 г гідроксиду натрію. Якщо відомі маси розчиненої речовини m та розчинника k, то масова частка розчиненої речовини становить, %:
![]() .
.
Масова концентрація С(М) – відношення маси розчиненої речовини m до загального об’єму розчину v, г/дм3 (мг/дм3 ):
![]() .
.
Молярна концентрація С(Х) показує, скільки молей розчиненої речовини міститься в 1дм3 розчину. Якщо відома маса розчиненої речовини m, його молярна маса М(Х) і об’єм розчину v, молярну концентрацію можна розрахувати за формулою, моль/дм3:
![]() .
.
Молярна концентрація еквівалента ( або нормальність ) С(1/Z*Х) показує, скільки еквівалентів розчиненої речовини міститься в 1дм3 розчину. Якщо відома маса розчиненої речовини m, її молярна маса еквівалента М(1/Z*Х) і об’єм розчину v, молярну концентрацію еквівалента розраховують за формулою, моль/дм3:
![]() .
.
ЗАДАЧІ
При виконанні вправ користуйтесь додатком.
Знайти молярні маси еквівалентів:
Азоту в сполуках N2O, NO, N2O3, NO2, N2O5.
Фосфору в сполуках P2O3, P2O5, PO2, PH3, P2O4.
Сірки в сполуках SO2, SO3, H2S.
Хрому в сполуках CrO, Cr2O3, CrO3.
Хлору в сполуках Cl2O, ClO2, (ClO3)2, Cl2O7.
Церію в сполуках Ce2O3, CeO2.
Вісмуту в сполуках BiO, Bi2O3, BiCl4, Bi2O5,
Марганцю в сполуках MnO, MnO2, Mn2O3, Mn2O7.
Миш’яку в сполуках AsI2, As2 O3, As2O5.
Селену в сполуках Se2Cl2, SeS, SeO2, SeO3, H2Se.
Телуру в сполуках TeO, TeO2, TeF5, TeO3.
Свинцю в сполуках Pb2O, PbO, PbO2.
Осмію в сполуках OsO, Os2O3, OsO2, OsF6, OsO4.
Визначити молярні маси еквівалентів нижче поданих елементів та сполук:
|
вар |
Елементи та сполуки | ||||||||
|
1 |
Fe2+ |
NO3- |
Ca2+ |
Na+ |
Mg2+ |
FeCl3 |
HNO3 |
KOH |
Ca(OH)2 |
|
2 |
Ca2+ |
Al3+ |
NH4+ |
F- |
HCO3- |
FeSO4 |
HCl |
FeCl3 |
Cl- |
|
3 |
K+ |
Pb2+ |
SO42- |
NO2- |
Mn2+ |
Fe2(SO4)3 |
H2SiO3 |
NaOH |
HCO3- |
|
4 |
Mg2+ |
Cl- |
Fe3+ |
KOH |
H3PO4 |
AlCl3 |
Na2CO3 |
F- |
SO42- |
|
5 |
Na+ |
Zn2+ |
SO4 2- |
HCO3- |
NO3- |
Al2(SO4)3 |
H2SO4 |
FeCl2 |
Ca(OH)2 |
|
6 |
OH- |
Ca2+ |
SO42- |
KOH |
Al3+ |
FeCl3 |
H3PO4 |
F- |
Na2SO4 |
|
7 |
H+ |
Fe2+ |
NO3 - |
NaOH |
SO42- |
CaCl2 |
H2SiO3 |
H3PO4 |
NaHCO3 |
|
8 |
Zn2+ |
Fe3+ |
NO2- |
HCO3- |
HCl |
FeSO4 |
Ca(OH)2 |
SO42- |
NaCl |
|
9 |
Cl- |
K+ |
Al3+ |
CaCO3 |
AlCl3 |
SO42- |
H2SO4 |
HCO3- |
Fe(OH)2 |
|
10 |
NH4+ |
Na+ |
Cl- |
PO43- |
NO3- |
Fe2(SO4)3 |
HNO3 |
SO42- |
Al(OH)3 |
|
11 |
NO2- |
Al3+ |
Pb2+ |
NaCl |
Mn2+ |
Fe(OH)3 |
H2CO3 |
FeCl3 |
Na2SO4 |
|
12 |
NO3- |
Na+ |
Mn2+ |
CaCO3 |
OCl- |
Mg(OH)2 |
HClO |
CO32- |
FeCl3 |
Визначити концентрацію іонів водню та гідроксид-іонів у розчині, рН якого:
|
|
|
|
Визначити рН розчину, якщо концентрація гідроксид-іонів становить, моль/дм3:
|
|
|
|
