
Лекция 8. Катализ. Обратимые реакции. Химическое равновесие. Принцип Ле-Шателье
.pdf
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
3.Катализ
3.Еще одним фактором, который оказывает существенное влияние на скорость реакции, является катализатор.
Катализатор – вещество, которое участвует в химической реакции и увеличивает (положительный катализ) или уменьшает (отрицательный катализ) её скорость, но само при этом не расходуется.
Что происходит с химической реакцией в присутствии катализатора? Все очень просто. Пусть в отсутствие катализатора происходит медленная химическая реакция между веществами А и В, в результате которой получается продукт Р.
Вприсутствии катализатора К вещество А быстро реагирует с веществом К
собразованием некоторого промежуточного соединения АК (его называют
интермедиат) АК, которое быстро реагирует с В и образует продукт реакции Р и катализатор К (катализатор регенерируется, т.е. не расходуется). Таким образом, вместо одной реакции стало две, но важны не столько количество стадий, сколько их скорость: вместо одной медленной реакции стало две быстрых. Как такое возможно?
Некаталитическая
реакция
А+В P (медленно)
Каталитическая реакция
А + К АК (быстро) АК + В Р + К (быстро)
Ответ, опять-таки, даёт энергетическая диаграмма процесса в присутствии катализатора. Ясно, что быстрая стадия характеризуется небольшой энергией активации. Вещество АК (интермедиат) является продуктом первой стадии и представляет собой минимум на кривой энергии. Затем вновь следует быстрая стадия (т.е. энергия активации вновь невелика), в результате которой образуется продукт реакции. Таким образом, одногорбый верблюд превратился в двугорбого.
О катализаторах следует сказать ещё несколько важных слов
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
1.Существует понятие отрицательный катализ, или ингибирование – в том случае, если вещество не ускоряет, а замедляет реакцию. Вещества, оказывающие подобное действие и при этом не расходующиеся, называются ингибиторами.
2.Если реакция обратима, то катализатор, как правило, ускоряет и прямую, и обратную реакции.
3.Как правило, в системе присутствуют вещества, которые снижают активность катализатора (каталитические яды), т.е. катализатор с течением времени отравляется и может совсем потерять активность.
4.Существует две разновидности катализа: гомогенный (вещество и катализатор
находятся в фазе раствора) и гетерогенный (вещество и катализатор находятся в разных фазах, как правило, твердый катализатор и раствор реакционной смеси).
Гомогенный катализ, как правило, эффективнее, однако при этом крайне сложно отделить катализатор от продуктов реакции.
Гетерогенный катализатор легко удаляется, например, фильтрованием, однако его активность сильно зависит от
а) площади поверхности; б) скорости диффузии (реагентов к поверхности катализатора и продуктов от нее)
в) скорости сорбции реагентов на поверхности и десорбции продуктов с нее
5. Вспомним биологию – процесс питания, как правило, связан с действием уникальных биокатализаторов – ферментов. Ферменты, как правило, представляют собой огромные белковые молекулы, масса которых составляет от тысячи до сотен тысяч а.е.м.
Действие ферментов отличают
-высокая активность (число превращений в единицу времени)
-высокая селективность (преимущественное образование одного продукта из нескольких возможных)
-работа при низких температурах (до 40oC). При более высокой температуре происходит денатурация белка, белок теряет свою третичную структуру – и каталитическую активность.
В настоящее время ферменты используют как лекарственные препараты (Мезим, Панкреатин, Инсулин и т.д.). Ферменты добавляют в стиральные порошки, правда, пользоваться таким порошком можно только при невысоких температурах. Кроме того, учтите, что, например, шерсть таким порошком стирать нельзя – ферменты будут разрушать ткань, так как она имеет биологическое происхождение.
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
Обратимые реакции
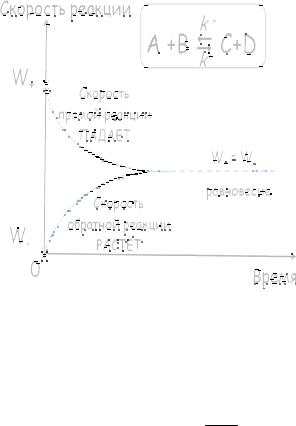
Обратимой называется реакция, которая может происходить в обоих направлениях, т.е. возможна реакция продуктов между собой с образованием реагентов (обратная реакция).
Рассмотрим обратимую гомогенную химическую реакцию, в которой из некоторых веществ A и B получаются продукты C и D, будем считать и прямую, и обратную реакции элементарными.
i A + j B m C + n D – i, j, m, n – коэффициенты.
Символ обратимой реакции – две стрелочки, направленные в противоположные стороны. Если стрелочка направлена только в одну сторону, реакцию считают необратимой.
Пусть для определенности константа скорости прямой реакции равна k+, константа скорости обратной реакции равна k – , начальные концентрации продуктов реакции C0 и D0 равны 0.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Запишем |
выражение |
для |
скоростей |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
прямой и обратной реакций |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W+ = k+ [A]i[B]j, |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W- = k– [C]m[D]n |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, скорость расходования |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вещества А определяется выражением |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(*) |
d[ A] |
= −ik + [ A]i [B] j + ik −[C]m [D]n . |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нетрудно понять, что в начальный |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
момент W+ >> W- = 0, однако с течением |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
времени W+ уменьшается (так как |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уменьшается |
концентрация |
реагентов), |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а W- возрастает |
(так как |
увеличивается |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
концентрация продуктов). |
|
|
|||
|
|
|||||||||||||||||||||||||||||||
Таким образом, неизбежно настанет такой момент времени, при котором |
||||||||||||||||||||||||||||||||
значения скоростей W+ и W- окажутся одинаковыми (причем ненулевыми!). |
|
|||||||||||||||||||||||||||||||
W+ = W-, следовательно, правая часть уравнения (*) обращается в нуль.
Решением уравнения d[ A] = 0 , является некоторое конкретное число [A] = const,
dt
т.е. [A] не зависит от времени и не меняется с течением времени.
Аналогичными рассуждениями нетрудно получить
[B] = const1, [C] = const2, [D] = const3.
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
Таким образом, оказалось, что для обратимой реакции существует некоторое состояние, при котором скорости прямой и обратной реакции равны, а концентрации веществ не меняются со временем. Данное состояние называется химическим равновесием.
Концентрации веществ, находящихся в химическом равновесии, называются
равновесными концентрациями.
W+ = k+ [A]i[B]j, |
W- = k– [C]m[D]n |
||||||
W+ = W- (равновесие) |
|||||||
k+ [A]iравн.[B]jравн. |
= k– [C]mравн.[D]nравн. |
||||||
( ) |
[C]mравн. [D]nравн. |
|
k + |
||||
|
|
|
= |
|
|
= K |
|
[ A] |
i |
j |
k |
− |
|||
|
равн. [B]равн. |
|
|
|
|||
Величина K называется константой химического равновесия, характеризует химическое равновесие в системе при данной температуре и равна отношению равновесных концентраций продуктов в степенях стехиометрических коэффициентов к равновесным концентрациям реагентов в степенях стехиометрических коэффициентов.
Химическое равновесие – это особое динамическое состояние системы, при котором в ней идут химические реакции, однако не происходит никаких изменений физических параметров (температуры, давления, объема, числа частиц, концентрации, показателя преломления, плотности и пр.).
Для нас химическое равновесие привлекательно, как «финиш» (окончание) химической реакции: поскольку в состоянии равновесия концентрации не изменяются, то достаточно определить эти концентрации – и Вы знаете все о состоянии системы.
Важное ограничение: при выводе формулы мы рассматривали гомогенную химическую реакцию. Полученный нами вывод справедлив и для случая гетерогенных реакций, однако нужно твердо запомнить: концентрация твердых веществ постоянна, поэтому она «включена» в константу скорости химической реакции (значит, в значение константы равновесия). Следовательно, твердые вещества в выражение для константы равновесия ( ) не входят.
Замечание. В рамках школьной программы мы ограничимся только простейшими расчетами равновесных систем и общими принципами управления равновесием химической реакции, однако в университете Вы познакомитесь с методами расчета констант химического равновесия для множества химических реакций в широком диапазоне температур.
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
Пример 1. Запишите выражение константы равновесия для следующих реакций
а) N2 (г) + 3 H2 (г) = 2 NH3 (г) |
Ответ: |
б) 2 KMnO4 (тв.) = K2MnO4 (тв.) + MnO2 (тв.) + O2 (г). |
Ответ: |
в) Zn (тв.) + 2 H+ (р-р) = Zn2+ (р-р) + H2 (г). |
Ответ: |
K = |
|
[NH |
3 ]2равн. |
|
|
[N 2 ]равн. [H 2 ]3равн. |
|||||
|
|||||
K = [O2 ]равн. |
|
|
|||
K = |
[H |
2 ]равн. [Zn2+ ]равн. |
|||
|
[H |
+ ]2равн. |
|||
|
|
||||
Всегда обращайте внимание на размерность константы равновесия. Как правило, константа равновесия выражается через концентрации и имеет соответствующую размерность. Так, в примере а) размерность константы равновесия M-2, в примере б) М, а в примере в) константа равновесия – число (безразмерная). Константу равновесия, выраженную через концентрации, обозначают KC.
Однако, как Вы знаете, для газообразных продуктов удобно приводить не концентрацию газа, а его парциальное давление (т.е. какую долю общего давления создает данный газ). В таком случае, в размерности константы равновесия появятся единицы давления – Паскали (Па), миллиметры ртутного столба (мм.рт.ст., или Торр, 133,3 Па), бары (105 Па) или атмосферы (атм., 101325 Па). Константу равновесия, выраженную через давления, обозначают KP.
Взаимосвязь между KP и KC получается очень легко, покажем на примере а)
Из уравнения состояния идеального газа Клапейрона-Менделеева PV = νRT следует, что давление прямо пропорционально концентрации: P = CRT (#).
Подставим в выражение для KP полученное выражение
|
|
P |
2 |
|
|
|
|
C |
2 (RT )2 |
|
|
|
|
|
|
|
|
KP |
= |
NH3 равн. |
|
KP |
= |
|
|
NH3 равн. |
|
|
|
K |
|
= (RT )−2 |
K |
|
|
P |
P 3 |
|
C |
(RT ) × C |
3 |
(RT )3 |
|
P |
C |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
N2 равн. |
H2 равн. |
|
|
|
|
N2 равн. |
|
H2 равн. |
|
|
|
|
|
|
|
Итак, для перехода от KC к KP величину KC необходимо умножить на произведение RT в степени, которая равна изменению количества вещества газообразных продуктов (в нашем примере из 4 моль газов получалось 2 моль аммиака, поэтому степень -2).
Пример 2. В начальный момент времени в системе находилось 1,2 М азота и 0,3 М кислорода. Через смесь пропустили электрический разряд, в результате чего образовался оксид азота(II) и установилось равновесие при температуре 298 К, причем концентрация кислорода в системе составила 0,05 М. Рассчитайте равновесные концентрации всех веществ и константы равновесия KC и KP.
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
Решение.
Записываем уравнение химической реакции: N2 (г) + O2 (г) 2 NO (г).
Затем вспомним школьные чудесные годы примерно третьего класса и составим очень полезную табличку, в которой столбики будут веществами а строки подпишем словами «Было», «Прореагировало» и «Стало».
Пусть израсходовалось x моль азота. По уравнению реакции кислорода израсходовалось столько же, а вот оксида азота(II) образовалось в 2 раза больше (коэффициент). Знак «минус» поставим для реагентов, знак «плюс» - для продуктов.
|
Азот N2 |
Кислород O2 |
Оксид азота(II) NO |
|
|
|
|
Было |
1,2 М |
0,30 М |
0 |
|
|
|
|
Прореагировало |
- x |
- x |
+ 2x |
|
|
|
|
Стало (равновесие) |
1,2 – x |
0,30 – x |
2x |
|
|
|
|
Так как нам известно, что кислорода в равновесии осталось 0,05 М, следовательно, x = 0,25 M. Тогда равновесные концентрации азота 0,95 М, кислорода 0,05М, оксида азота(II) – 0,50 М.
Выражение для константы равновесия: KC = |
[NO]2равн. |
, откуда KC = 5,26 (безразмерная) |
|
[N 2 ]равн. [O2 ]равн. |
|||
|
|
Так как изменение количества газообразных продуктов в реакции не происходит, то
KP = KC = 5,26.
Управление химическим равновесием. Принцип Ле-Шателье.
(разобрать самостоятельно)
Рассмотрим наши возможности управлять химическим равновесием на примере промышленного окисления оксида серы(IV) до оксида серы(VI) на катализаторе V2O5.
2 SO2 (г.) + O2 (г.) 2 SO3 (г.) + Q
Пусть в некоторый момент времени система достигла состояния равновесия.
Принцип Ле-Шателье: если на химическую систему, находящуюся в равновесии, оказывают внешнее воздействие, то положение равновесия в системе смещается таким образом, чтобы уменьшить это воздействие.

Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
Параметр 1. Концентрация веществ: увеличим концентрацию кислорода в реакционной смеси. При этом вырастет скорость прямой реакции W+ = k+[SO2]2[O2], а скорость обратной реакции в начальный момент времени не изменится W-=k-[SO3]2. Следовательно, равновесие нарушено – и в системе происходит прямой процесс. Расходование кислорода и оксида серы(IV) и образование триоксида серы будет продолжаться до тех пор, пока система не достигнет нового состояния равновесия.
Следовательно, добавление в реакционную смесь реагентов смещает положение равновесия в сторону прямой реакции, а добавление продуктов – в сторону обратной реакции.
Параметр 2. Увеличение температуры.
Реакция окисления оксида серы(IV) экзотермическая, а реакция разложения оксида серы(VI) – эндотермическая. Увеличение температуры эквивалентно тому, что мы сообщили системе некоторое количество теплоты. В этом случае система будет стараться использовать (поглотить) это количество теплоты – и равновесие смещается в сторону эндотермической (в данном случае, обратной) реакции. Для увеличения содержания триоксида серы реакционную смесь следует не нагревать, а охлаждать.
Таким образом, повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение температуры – в сторону экзотермической реакции.
Параметр 3. Увеличение давления.
Давление имеет значение только в том случае, если в реакционной смеси присутствуют вещества в газообразном состоянии. Увеличение давления в n раз эквивалентно увеличению концентрации каждого газа в n раз, см. уравнение (#).
Если в реакции одинаковое количество газообразных реагентов и продуктов (в моль), то скорости прямой и обратной реакции изменятся одинаково и состояние равновесия сохранится.
Если количества газообразных реагентов и продуктов различны, то при увеличении давления равновесие смещается в сторону меньшего объема газообразных веществ (система «сжимается»), а при уменьшении давления – в сторону большего их объема (система разрежается1, расширяется).
Например, в рассматриваемой реакции окисления диоксида серы, газообразными являются 3 моль реагентов и только 2 моль продуктов, поэтому увеличение давления способствует смещению равновесия в сторону образования триоксида серы (прямой реакции).
1 От слова «редкий», т.е. частицы располагаются реже, на больших расстояниях между ними.
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие. Параметр 4. Использование катализатора.
Небольшой сюрприз от преподавателей. Дело в том, что катализатор позволяет Вам найти более легкую дорогу между пунктами А и Б, но никоим образом не изменяет относительное расположение этих пунктов. Более того катализатор ускоряет и прямую, и обратную реакции, не оказывая предпочтения ни одной из них.
Итак, важно запомнить: катализатор не влияет на положение равновесия химической реакции, а только ускоряет момент его наступления.
Поэтому введение катализатора на приведет к смещению равновесия.
Таким образом, ответ на вопрос задачи должен звучать так
«Согласно принципу Ле-Шателье к увеличению содержания оксида серы(VI) в реакционной смеси
Лекция 8.
Факторы, влияющие на скорость реакции. Химическое равновесие.
Ключевые термины
Фаза |
Скорость гомогенной химической реакции |
Гомогенная система |
Скорость гетерогенной химической реакции |
Гомогенная реакция |
Химическая кинетика |
Гетерогенная система |
Закон действующих масс |
Гетерогенная реакция |
Элементарная (простая) реакция |
Константа скорости |
Сложная (составная) реакция, брутто-реакция |
Порядок реакции |
Реакция первого порядка / мономолекулярная реакция |
Катализатор |
Реакция второго порядка / бимолекулярная реакция |
Переходное состояние |
Реакция третьего порядка / тримолекулярная реакция |
Интермедиат |
Порядок реакции по веществу |
Ферменты (энзимы) |
Уравнение Вант-Гоффа |
|
Температурный коэффициент |
|
Уравнение Аррениуса |
|
|
