
1_FIZIChESKAYa_HIMIYa_1
.pdf
для которого первое приближение Дебая – Хюккеля принимает вид
lg f (N ) |
1,825 106 |
|
н z2 |
н z2 |
|
|
(еT )3/ 2 |
|
|
|
|
I |
|
|
|
н |
н |
|
|
|
|
|
|
|
|
|
|
откуда, принимая во внимание условия электронейтральности ν+ z+ = - ν- z-, можно преобразоватьсомножитель перед знаком квадратного корня
н z2 |
н z2 |
|
- н z |
|
z |
|
н z |
|
z |
z |
|
z |
н |
н |
| z |
|
z |
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
н |
н |
|
|
н |
|
н |
|
|
|
|
|
н |
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и тогда предельный закон Дебая – Хюккеля для выражения среднего коэффициента активности принимает вид
lg f (N ) | z z | |
1,825 |
106 |
I . |
|
(еT )3/ 2 |
||||
|
|
|||
Теоретически рассчитанные по этой формуле значения рационального коэффициента активности ( f (N ) ) можно сопоставить с экспериментальными данными. При этом необходимо учитывать, что экспериментальные данные для растворов электролитов обычно приводятся в моляльной шкале (γ±).
Для сопоставления величин необходимо пересчет производится по формуле
f ( N ) г (1 10 3 нM1m)
где M1 – молярная масса растворителя, m - моляльная концентрация раствора. Из последнего о соотношения видно, что в разбавленных растворах (т.е. при m
≤ 0,001)
f ( N ) г
C увеличением концентрации различие становится всё более существенным. Так, например, в водном растворе хлорида натрия при m = 0,1 моль/кг H2O γ± =
0,778 и |
f (N ) =0,781, а при m = 1 моль/кг H O γ |
± |
= 0,657 и |
f (N ) = 0,681. |
|
|
|
2 |
|
|
|
Предельный закон позволил объяснить ряд экспериментальных результатов. Так, для водного раствора 1,1-валентного электролита при
температуре T = 293 К и диэлектрической |
проницаемости воды еH2 O 80,1 |
||
выражение ( ) принимает вид |
|
|
|
lg f (N ) |
1,825 |
106 z2 |
I 0,507z2 I , |
|
(80,1 |
293)3/ 2 |
|
что с точностью ≈ 1 % соответствует эмпирическому соотношению lg г lg f (N) 0,5z2 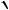
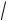 C ,
C ,
ранее полученному Я.Бренстэдом для подобных разбавленных растворов.
191

В соответствии с предельным законом Дебая и Гюккеля коэффициент активности иона в данном растворе зависит только от заряда иона и ионной силы раствора
lgг 0.5 z2 I |
(3.1.23a) |
В теории растворов эта закономерность, обнаруженная Льюисом и Рендаллом,
известна как правило ионной силы:
Ионы с одинаковым зарядом независимо от их природы в растворах с одинаковой ионной силой имеют равные коэффициенты активности.
Это правило выполняется при условии, что I ≤ 1.
Достижения теории сильных электролитов Дебая – Гюкккеля признаны успешными в области малых концентраций, однако с повышением концентрации электролита в растворе расхождение теории и эксперимента становятся всё более существенными.
Ограничения применимости первого приближения теории областью низких концентраций электролита была обусловлена принятыми допущениями.
В сильно разбавленных растворах электролитов γ± → 1, в то время как при высоких концентрациях коэффициенты активности могут достигать десятков и даже нескольких сотен. Так, например для 5.5М раствора UO2(ClO4)2 = 1457, а для 2.5М раствора CdI2 = 0.0168.
Величины среднеионных коэффициентов активности для различных электролитов в зависимости от их концентрации в растворе приведены в справочниках (см., например, [КС]).
При использовании молярной шкалы концентраций формула (3.1.20) примет вид:
a±,C = C± ∙ f± = s∙ C ∙ f±
где c и f± - соответственно молярная концентрация и молярный среднеионный коэффициент активности.
В разбавленных водных растворах величины среднеионных активностей численно совпадают, поэтому далее принимаем:
a±,m ≈ a±,C ≈ a±
Средние коэффициенты активности во всех концентрационных шкалах при бесконечном разбавлении раствора стремятся к единице, поскольку вследствие увеличения расстояния между ионами взаимодействие между ними снижается до нуля и раствор приобретает идеальные свойства.
192

В качестве стандартного состояния выбирают то, для которого коэффициенты активности равны единице, а поскольку одновременно и активность соли должна быть равна единице, то такое стандартное состояние реализовано быть не может и представляет собой гипотетический раствор, в котором активности всех ионов равны единице и одновременно отсутствует ион-ионное взаимодействие.
Для определения активности и коэффициентов активности существует несколько методов, при этом они полностью аналогичны для растворов электролитов и неэлектролитов.
Таким образом, выражение для константы равновесия любого обратимого процесса, протекающего в растворе с участием электролитов, следует писать, используя соответствующие активности. Так, в случае диссоциации слабого электролита по схеме (1 б), например,
CH3COOH CH3COO- + H+,
термодинамическая константа равновесия равна
|
|
a |
|
a |
|
|
Ka |
H |
a |
CH 3COO |
(3.1.24) |
|
|
|
|||
|
|
|
CH 3COOH |
|
|
В заключении |
отметим, |
что |
использование активностей позволяет |
||
зависимости, полученные при теоретическом рассмотрении идеальных систем (где взаимодействием между составляющими систему частицами можно пренебречь), успешно применять для описания закономерностей, присущих реальным системам.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
ВОДОРОДНЫЙ И ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛИ
Экспериментально показано, что химически чистая вода сама по себе также является электролитом, но очень слабым. В результате межмолекулярного взаимодействия незначительное число молекул воды диссоциируют с образованием ионов водорода и гидроксид-ионов по схеме:
Н2О Н+ + ОН- |
(3.1.25) |
Водородный ион Н+, является, по существу, элементарной частицей (протоном), с размерами в 105 раз меньшими, чем у атома водорода.
Вследствие малых размеров при огромном относительном заряде (+1) изолированный протон взаимодействует с электронными оболочками полярных молекул воды с образованием иона гидроксония:
193

Н+ + Н2О = Н3О+, Н 298 = 707 кДж (3.1.26)
Гидратация иона гидроксония также характеризуется большим
экзотермическим эффектом |
|
Н3О+ + nН2О = Н3О+ nН2О, |
Н 298 = 460 кДж (3.1.27) |
Гидроксид-ион взаимодействует с водой в соответствии с уравнением
ОН- + Н2О = Н3О2- |
(3.1.28) |
Учитывая гидратацию ионов, диссоциацию воды следовало бы изображать в виде
(1 + m + n) Н2О= (Н m Н2О)+ + (ОН n Н2О)- (3.1.29)
Вучебной литературе, однако, диссоциацию воды описывают упрощенным уравнением вида (3.1.25). При этом символы Н+ и ОН- используются для обозначения гидратированных продуктов ионного распада воды (Н3О+ и Н3О2-).
Всоответствии с (3.1.24) выражение для константы равновесия процесса ионизации воды примет вид
Кдис |
[ H ] [OH ] |
(3.1.30) |
|
[ H2O] |
|
Термодинамические расчеты показывают, что распаду на ионы подвержена лишь очень ничтожная часть молекул воды. Поэтому можно считать, что равновесная концентрация недиссоциированных молекул практически равна общей концентрации, т. е.
H2O CH2O 1000 |
55.56 |
моль/л |
18 |
|
|
и, следовательно, |
|
|
Кдис [H2O] = Кдисс 55.56 = Кw, |
(3.1.31) |
|
где Кw - константа, названная ионным произведением воды |
||
Кw = [H+] [OH-] |
|
(3.1.32) |
Константа равновесия Кд = f(Т), поэтому значение и Кw также изменяется с температурой. Так при 25 С Кд = 1.8 10-16 и ионное произведение
Кw = 1.8 10-16 55,56 1 10-14 |
(3.1.33) |
С ростом температуры Кw увеличивается, с понижением - уменьшается. Для приближенных расчетов, относящихся к комнатной температуре ( 20 25 С), обычно используют значение Кw = 10-14.
Ионное произведение воды является одной из важнейших характеристик водных растворов, величина которого зависит от температуры. Зная Кw, можно легко определить концентрацию ионов гидроксония при известной
194

концентрации гидроксид-ионов, и наоборот. Поскольку в чистой воде согласно (16) концентрации ионов равны, то
[H+] = [OH-] = 
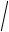 Kw = 10-7, моль/л (3.1.34)
Kw = 10-7, моль/л (3.1.34)
Если концентрации ионов Н+ и ОН- в растворе равны, то он называется нейтральным. В том случае, если [H+] 10-7 моль/л раствор будет нейтральным, и наоборот, при [H+] 10-7 моль/л - щелочную.
Для количественной характеристики реакции среды используется водородный показатель ( рН )23 раствора
рН = - lg[H+], |
(3.1.35) |
где концентрация выражена в моль/л.
ПО АНАЛОГИИ С (3.1.35) ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛЬ РОН РАВЕН
рОН = lg[OH-] |
(3.1.36) |
Логарифмируя (23) для температуры 25 C |
получим |
рКw = pH + pOH = 14 |
(3.1.37) |
Таким образом в нейтральном растворе рН = 7, в кислом рН 7, а в щелочном рН 7.
Для водных растворов сильных электролитов (3.1.32) следует писать в виде
KW aH aOH , |
(3.1.38) |
pH lg aH |
(3.1.39) |
pOH lg aOH |
(3.1.40) |
В сильно разбавленных растворах вместо активностей можно использовать концентрации. Согласно (28) значение водородного показателя для водных растворов должно изменяться в пределах
0 рН 14 |
(3.1.41) |
Однако, на практике можно встретить растворы как с рН 0, так и рН 14, что характерно для растворов сильных электролитов. Например, в десятимолярном
растворе соляной кислоты , 10.44, следовательно,
HCl
a |
|
a 10.44 10 104.4 |
и рН= –lg 104.4 = - 2.02. |
H |
|
|
|
В растворе КОН с m = 2 моль/кг H2O водородный показатель равен 14.248.
23 p – первая буква датского слова potenz – математическая степень, H – символ водорода.
195

ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
В гетерогенной системе, состоящей из насыщенного раствора малорастворимого соединения, например, AgCl, находящегося в контакте с твёрдой фазой AgCl, устанавливается равновесие, которое описывается уравнениями вида
AgCl(тв.) Ag+ + Cl-
При неизменной температуре произведение равновесных концентраций ионов в насыщенном растворе малорастворимого соединения представляет собой постоянную величину, которая называется произведением растворимости и условно обозначается символом ПР.
Для хлорида серебра в водном растворе при t = 25 °C
ПРAgCl = [Ag+]∙[Cl-] = 1,73∙10-10
В более строгих расчетах произведение растворимости следует записывать через активности ионов в насыщенном растворе малорастворимого соединения
ПР aAg aCl
Для приближенных расчетов, а также в тех случаях когда ионная сила растворов малорастворимых электролитов не превышает 0,001, активности ионов можно приравнять их аналитическим концентрациям.
На основании величины ПР малорастворимого соединения (соли) можно вычислить его растворимость (в моль/л и г/мл).
В общем случае для малорастворимого электролита, диссоциирующего по
схеме
MemAn → mMen+ + nAm-
где Me – катион, A – анион, если обозначить растворимость соли буквой s, а затем выразить через эту величину равновесные концентрации ионов Me и А в насыщенном растворе
[Me] = m s |
и |
[A] = n s, |
то выражение для ПР примет вид |
|
|
ПР(MemAn) = [Men+]m∙[Am-]n = (m s )m (n s )n = mn sm+n
откуда
s [ПР/(mn)] (m n)
а для растворимости симметричных электролитов, таких, как, например, AgCl,
BaSO4,
s 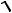 ПР , моль/л
ПР , моль/л
196

БУФЕРНЫЕ РАСТВОРЫ
В лабораторной практике часто возникает необходимость применения растворов, способных поддерживать (в определённых пределах) постоянное значение водородного показателя. Такие растворы называются буферными.
Буферными называются растворы, способные поддерживать постоянное значение рН при добавлении небольших количеств кислот (оснований) или разбавлении водой. Такими свойствами обладают растворы, содержащие слабую кислоту и ее соль, образованную с сильным основанием, или слабое основание и его соль с сильной кислотой.
В качестве примера рассмотрим ацетатный буферный раствор, т.е. смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa. В соответствии с уравнением диссоциации уксусной кислоты
СН3СООН СН3СОО- + Н+
константа диссоциации
a |
|
a |
|
, отсюда |
aCH COOH |
|
Kдис |
a3CH COOH |
H |
|
aH Kдис aCH3COO |
||
CH COO |
|
|
|
|
|
|
|
3 |
|
|
|
|
3 |
Введение в раствор слабой кислоты хорошо диссоциированной соли СН3СООNa смещает равновесие влево. Поэтому активность недиссоциированной кислоты становится равной активности растворенной слабой кислоты, которая в разбавленном растворе равна концентрации кислоты Скисл.. Активность аниона СН3СОО- будет определяться активностью аниона
прибавленной соли: aCH3COONa f CCH3COONa . Поэтому
aH Kдис f |
сCH COOH |
|
|
c3 |
|
|
CH COONa |
|
|
|
3 |
Подбирая соотношение Скисл./Ссоль можно приготовить растворы с заданным значением рН.
Механизм регулирования реакции среды буферным раствором основан на его способности таким образом смещать установившееся равновесие, что концентрация ионов водорода остается практически неизменной. Так прибавление небольших количеств сильной кислоты к ацетатному буферу приводит к сдвигу равновесия в сторону образования малодиссоциированного соединения (уксусной кислоты)
СН3СООNa + HCl CH3COOH + NaCl
или в ионно-молекулярной форме СН3СОО- + Н+ СН3СООН
197

Связывание вводимых ионов Н+ увеличивает концентрацию недиссоциированных молекул СН3СООН, концентрация водородных ионов, а, следовательно, и рН раствора не изменяется. Добавление небольших количеств щелочи смещает равновесие в противоположном направлении
СН3СООН + NaOH СН3СООNа + Н2О
или
СН3СООН + ОН- СН3СОО- + Н2О
т.е. вводимые в раствор гидроксид-ионы ОН- связываются в малодиссоциированное соединение Н2О.
При разбавлении буферного раствора концентрация ионов Н+ практически не изменяется, поскольку уменьшение концентрации ацетат-ионов СН3СОО- приводит к росту степени диссоциации уксусной кислоты.
ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Химические реакции в растворах электролитов, являющиеся результатом взаимодействия между ионами и молекулами и протекающие без изменения степеней окисления элементов, называются ионными реакциями. В учебной литературе для этих реакций можно встретить названия "обменные реакции", "реакции ионного обмена".
Для ответа на вопрос, возможно ли протекание ионной реакции в заданном направлении, можно руководствоваться следующим правилом:
В растворах электролитов самопроизвольное протекание реакции ионного обмена в заданном направлении возможно, если она приведёт к усеньшению концентрации ионов в растворе вследствие образования слабого электролита, малорастворимой соли.
Реакции ионного обмена являются обратимыми. При заданных параметрах состояния каждой из этих реакций соответствует определенное состояние динамического равновесия, которое смещено в ту сторону, где происходит наиболее полное (прочное) связывание ионов.
Уравнения ионных реакций в растворах электролитов представляют в
молекулярной и молекулярно-ионной формах.
При составлении молекулярно-ионных уравнений необходимо соблюдать следующие правила: сильные электролиты следует условно изображать в виде суммы отдельных составляющих их ионов; слабые электролиты и малорастворимые соли (осадки) - в виде молекул24.
Реакции нейтрализации так же относятся к этому типу, поскольку в них образуются молекулы слабого электролита - воды. В зависимости от силы
24 См. курс общей химии
198

вступающих в реакцию кислот и оснований сокращенные ионные уравнения имеют различный вид.
ГИДРОЛИЗ СОЛЕЙ
Гидролизом называется обменное взаимодействие некоторых солей с водой, которое происходит лишь в тех случаях, когда ионы, образующиеся при диссоциации соли, способны образовывать с ионами - продуктами ионизации воды (Н+, ОН-) малодиссоциированные соединения - молекулы или более сложные ионы.
Гидролизу подвергаются соли, образованные: анионом слабой кислоты и катионом сильного основания (NаNO2, CH3COONa, KClO и др.); катионом слабого основания и анионом сильной кислоты (NH4Cl, C6H5NH3NO3 и др.); анионом слабой кислоты и катионом слабого основания (NH4CN, CH3COONH4
идр.).
Вобычных условиях гидролизу не подвергаются соли, образованные сильной кислотой и сильным основанием.
Рассмотрим первый случай гидролиза на примере ацетата натрия – соли сильного основания и слабой кислоты:
СН3СООNa + Н2О СН3СООН + NаОН или в сокращенной ионно-молекулярной форме
СН3СОО- + Н2О СН3СООН + ОН-
Как видно из этого уравнения, реакция раствора соли в результате гидролиза является щелочной (рН 7). Взаимосвязь равновесных концентраций с термодинамической константой равновесия имеет вид
K [CH3COOH ] [OH ] f (T ) . [CH3COO ] [H2O]
Равновесная концентрация воды является практически постоянной величиной, поэтому это выражение представляют в виде
K [H2O] Kг [CH3COOH ] [OH ] f (T ) , [CH3COO ]
где Kг – называется константой гидролиза. Домножим числитель и знаменатель правой части на величину [H+], тогда
Kг |
[CH COOH] [OH ] [H ] |
|
K |
|
3 |
|
W |
||
|
|
|
||
|
[CH3COO ] [H ] |
|
Kдисс.,CH COOH |
|
|
|
|
|
3 |
199

Как видно, константа гидролиза соли сильного основания и слабой кислоты равна отношению ионного произведения воды и константы диссоциации кислоты:
Kг KW / Kдис.,к ты
Если обозначить греческой буквой степень гидролиза соли
= Nгидр. / N = Cгидр. / C,
то равновесные концентрации реагирующих веществ можно связать с исходной концентрацией ( C, моль/л ) соли в растворе
[CH3COO-] = C - C, [CH3COOH] = [H+] = C,
и тогда
Kг вСС ввСС в12 вС .
Если << 1, то
Kг в2 С
Аналогичным образом можно рассмотреть гидролиз соли, образованной анионом сильной кислоты и катионом слабого основания. В качестве примера рассмотрим гидролиз хлорида аммония:
NH4Cl + H2O NH4OH + HCl
NH4++ H2O NH4OH + H+
Раствор вследствие гидролиза по катиону имеет кислую реакцию, а константа гидролиза равна:
Kг |
[NH OH] [H ] |
|
[NH OH] [H ] [OH ] |
|
|
K |
W |
||
4 |
|
4 |
|
|
|
||||
|
|
|
|
|
|
|
|||
|
[NH ] |
|
[NH ] [OH ] |
|
K |
дисс..NH4OH |
|||
|
|
4 |
|
|
4 |
|
|
||
Итак, константа гидролиза соли слабого основания и сильной кислоты равна отношению величин ионного произведения воды и константы диссоциации слабого основания
Kг KW / Kдис..основания
Рассуждая подобным образом, можно показать*, что константа гидролиза соли слабого основания и слабой кислоты равна
Kг KW /(Kдис..основания Kдис..кислоты)
Приведённые выше формулы показывают, что, зная константы гидролиза солей и молярные концентрации их растворов, можно определить степень
* Рекомендуется сделать это самостоятельно
200
