
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
Направленность ковалентной связи. Гибридизация орбиталей
Направленность ковалентной связи обусловлена определенной направленностьюв пространствеp-,d-,f-орбиталей, образующих химическую связь, а также обеспечениемоптимальныхусловий их перекрывания.
При образовании σ-связи с участиемs-орбиталей говорить о «направленности» не имеет смысла, т.к.s-орбитали имеют сферическую симметрию. Если связи образуютсяp-,d-илиf-орбиталями, то ковалентная связь – направленная. Например, образование молекулы сероводорода можно представить в виде следующих валентных схем (рисунок 3.6).
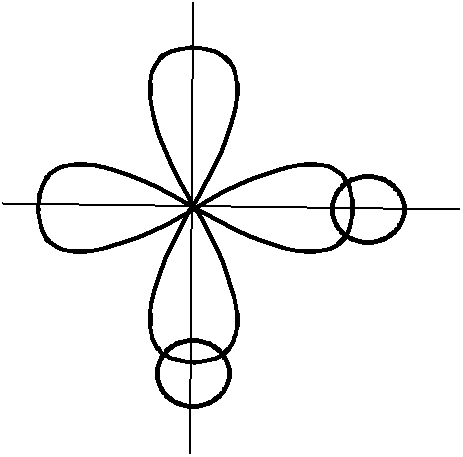
Из того, что p-орбитали атома серы ориентированы в пространстве под углом 900, следует ожидать, что молекулаH2Sимеет угловую структуру, и валентный угол (угол между связямиS–H) должен быть таким же (на самом деле 920, что близко к предсказанному МВС).
|
Рисунок 3.6 – Перекрывание атомных орбиталей при образовании молекулы H2S |
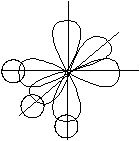
Рисунок 3.7 – Перекрывание атомных орбиталей при образовании молекулы NH3 |
Из валентной схемы образования молекулы NH3(рисунок 3.7) следует, что она должна быть пирамидальной, и валентные углы в ней также должны быть по 900. Однако с действительностью совпадает только первое утверждение: молекула аммиака действительно имеет пирамидальную структуру, но валентные углы заметно больше (1070 ), т.е. ближе к тетраэдрическим.
Подобный прогноз строения молекулы BCl3 еще более не соответствует фактическому ее строению. Прежде всего отметим, что для образования трех связей по обменному механизму атом бора должен быть в возбужденном состоянии:2s12p2:
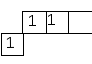
При таком распределении электронов в образовании трех связей с атомами фтора должны участвовать разные по энергии орбитали атома бора (одна s- и двеp-орбитали). Но в таком случае эти связи должны различаться длиной и энергией, что не соответствует действительности: на самом деле все три связи в молекулеBCl3 равноценные. Очевидно, что-то в модели необходимо модернизировать.
Л. Полинг и др. авторы вполне логично исходили из того, что равные по энергии связи могут образоваться атомом при участии равных по энергии его атомных орбиталей, в данном случае – трех равных по энергии валентных орбиталей атома бора. Так были введены представления о том, что в образовании ковалентных связей могут участвовать не только «чистые» атомные орбитали (s-,p-,d-и т.д.), но их «гибриды» в различном сочетании:sp-,dp-,sp2-,sp3-,dsp2-,sp3d-,sp3d2-и др. комбинации (подумайте, а не противоречат ли эти представления принципам квантования орбитального момента электрона, рассмотренным в теме 2?).
Число образующихся гибридных орбиталей равно числу атомных орбиталей, участвовавших в гибридизации (рисунок 3.8). Например, одна s- и однаp-орбитали образуют двеsp-гибридных орбитали. При гибридизации однойs- и двухp-орбиталей образуются три гибридныхsp2-орбитали. Гибридных орбиталейsp3- иdsp2- образуется по четыре,sp3d– пять,sp3d2– шесть и т.д.
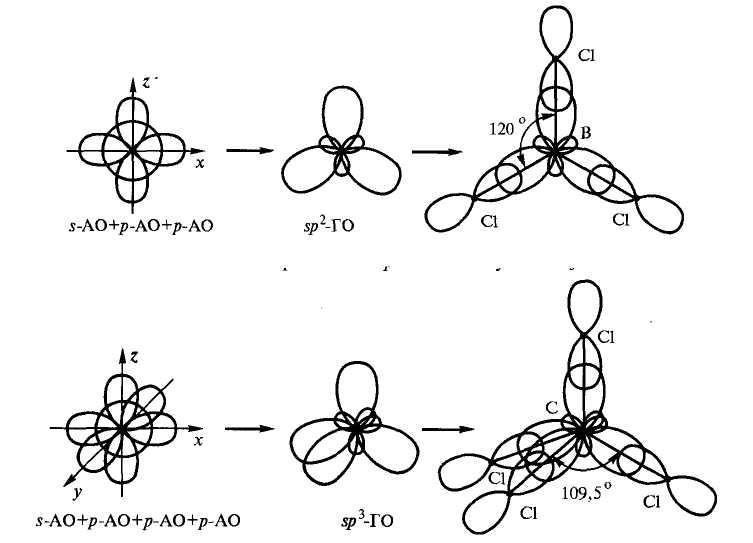
Рисунок 3.8 – Схема sp2-гибридизации орбиталей атома бора при образовании молекулыBCl3иsp3-гибридтизации орбиталей атома углерода при образовании молекулыCCl4
Направленность гибридных орбиталей в пространстве определятся тем же, что и «чистых» атомных p-,d-,f-орбиталей, т.е. наименьшим отталкиванием электронов связи друг от друга. Поэтому две гибридныеsp- орбитали образуют угол 1800, три гибридныеsp2-орбитали ориентированы в плоскости под углом 1200, четыре орбитали приsp3-гибридизации ориентированы к вершинам тетраэдра, а приdsp2-гибридизации – к вершинам квадрата, пятьsp3d-орбиталей направлены к вершинам тригональной бипирамиды, а шесть орбиталейsp3d-– к вершинам октаэдра.
