- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
12 Электрохимические реакции
Механизм образования двойного электрического слоя; понятие об
электродном потенциале
Известно, что при контакте с водой металлы, в зависимости от их природы, ведут себя по-разному. Щелочные и щелочно-земельные металлы «растворяются» в воде (окисляются ею, образуя растворимые гидроксиды). Магний, алюминий окисляются водой, но только в тонком поверхностном слое (т. к. их гидроксиды в воде малорастворимы). И, наконец, большая часть металлов с жидкой водой «практически не взаимодействуют». Однако даже металлы, относящиеся к «благородным», не абсолютно инертны в контакте с водой. Например, давно известны бактерицидные свойства «святой воды», обусловленные переходом в воду ионов из металлического серебра. Каков механизм появления этих ионов в растворе?
Металлы – это твердые (кроме ртути) вещества, в узлах кристаллической решетки которых находятся катионы, связанные друг с другом делокализованными валентными электронами (металлической связью). При контакте металла с водой в результате ион-дипольного взаимодействия катионов металла (Men+) с молекулами (диполями) воды часть их перейдет в раствор в виде гидратов (Men+ ·yH2O), а на металле появится избыток электронов (металл «поляризуется катодно»).
Таким образом, на границе металл/раствор образуется двойной электрический слой: отрицательно заряженная поверхность металла/слой катионов металла в растворе, что можно представить следующей схемой:
xMe + yН2О [(x-z)Me + zn·е] + zMen+ ·yH2O.
металлич. металлич. катионы металла
пластина пластина в растворе

В результате образования двойного электрического слоя на границе металл/раствор образуется своего рода «конденсатор» и возникает скачок потенциала, который называют электродным потенциалом и обозначают φ.
Величина электродного потенциала зависит от многих факторов, влияние которых можно выявить, рассмотрев всю последовательность превращений металла при переходе его из простого вещества в раствор. Очевидно, что такой переход включает следующие изменения энергии:
– затраты ее на разрыв химических связей
между атомами в решетке металла (Ереш);
затраты ее на разрыв химических связей
между атомами в решетке металла (Ереш);
– расход энергии на ионизацию атомов с превращением их в катионы (характеризуется потенциалом ионизации, I);
– выделение энергии при связывании катионов металла с молекулами воды (энергия гидратации, Егидр.).
Чем меньше энергия металлической решетки и потенциал ионизации атомов металла и чем больше энергия гидратации (сольватации) катионов металла, тем более энергетически выгодным будет переход ионов металла в раствор, тем большим по абсолютной величине будет электродный потенциал. Если учесть, что на величину потенциала влияют также пространственное распределение ионов металла в растворе, изменение структуры растворителя и т. д., то станет ясно, что рассчитать абсолютную величину электродного потенциала не представляется возможным.
С другой стороны, экспериментальноеопределениеабсолютнойвеличины электродного потенциала также невозможно вследствие того, что хотя двойной электрический слой и представляет собой своеобразный «конденсатор», подключить к нему измерительную систему не удастся, т.к. одна из «обкладок» такого конденсатора – это катионы металла в растворе.
Вследствие изложенных выше причин остается только один вариант – определять не абсолютную, а относительнуювеличину электродного потенциала илиразность электродных потенциаловдвух систем (полуэлементов), соединенных электрической цепью.
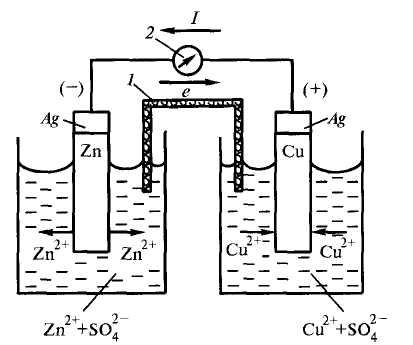
На приведенном ниже рисунке 12.1 показан вариант такой системы, включающей цинковый и медный полуэлементы.
|
Рисунок 12.1 – Схема медно-цинкового гальванического элемента |
Такие системы называют гальваническими элементами, в которых полуэлементы соединены внутренней цепью– электролитическим мостиком (1) ивнешней цепью(2). Внешняя цепь выполняет функцию транспортировки электронов с электрода, поляризованного более отрицательно (его называютанодом) на электрод, поляризованный менее отрицательно (его называюткатодом). Внутренняя цепь служит для транспортировки ионов (анионов) электролита в направлении, обратном движению электронов.
|
Вследствие того, что металлический цинк окисляется легче, чем медь, его потенциал – более отрицательный, чем для меди. В таком случае цинк «поляризован анодно», а медь «поляризована катодно». Следовательно, на рисунке 12.1 цинковый электрод – это анод, а медный – катод.
Условия, необходимые для работы гальванического элемента
Если в схеме, приведенной выше, единственным электролитом является вода, то такой гальванический элемент работать не будет и разность электродных потенциалов измерить не удастся. Для работы гальванического элемента необходимо выполнение следующих условий:
– металлы полуэлементов должны быть погружены в растворы их солей;
– металлы полуэлементов должны иметь электрический контактдруг с другом (соединятьсявнешней цепью);
– должен быть электрический контакт растворовполуэлементов для обеспечения противотока ионов (наличиевнутренней цепи).
При обеспечении этих условий элемент будет работать до выравнивания потенциалов полуэлементов.
Разность электродных потенциалов двух полуэлементов, например, цинкового и медного (Ер) – это разность потенциалов катодного и анодного процессов:
Eр= Екатода –
Е анода = Е![]() –
Е
–
Е![]() ,
,
Ер называют электродвижущей силой (ЭДС) гальванического элемента.
Вследствие того, что на практике используют не абсолютные, а относительные величины потенциалов, возникла необходимость определять их относительно одной и той же системы сравнения. В качестве электрода (полуэлемента) сравнения был выбран «водородный электрод». Устройство этого электрода показано на рисунке 12.2.
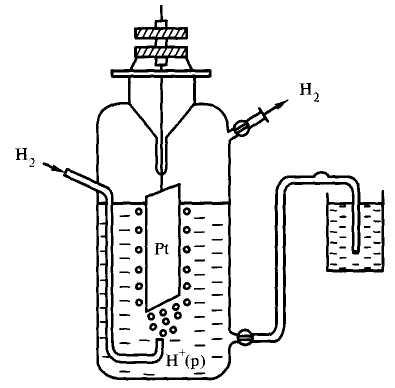
Рисунок 12.2 – Схема водородного электрода
Основной элемент водородного электрода – это платиновая пластина, покрытая платиновой чернью и погруженная в раствор серной или хлорной кислоты.
При пропускании через раствор молекулярного
водорода он сорбируется на платиновом
электроде, при этом активная платиновая
чернь способствует его атомизации. В
результате между водородом на пластине
и в растворе устанавливается равновесие
H++eH(г)
и возникает скачок потенциала Е![]() .
.
Факторы, влияющие на величину электродного потенциала; уравнение Нернста; стандартный электродный потенциал
Стандартный электродный потенциал (Е0) окислительно-восстановительной системы – это потенциал, измеренный в стандартных условиях: приT= 298Kи молярности (активности) веществ, участвующих в превращении, равной 1 моль/л. Электродный потенциал измеряется в Вольтах (В).Для водородного электрода стандартный потенциал условно приняли за «ноль».
Если условия нестандартные, то величину электродного потенциала рассчитывают по уравнению Нернста.Уравнение Нернста показывает зависимость электродного потенциала от природы веществ, участвующих в равновесии (через Е0), их концентрации и температуры
Е = Е0+![]() ,
(12.1)
,
(12.1)
где R– универсальная газовая постоянная (8,31 Дж/моль·К);
T– температура в градусах Кельвина;
F– число Фарадея (заряд электронов количеством 1 моль, 96500 Кл/моль);
n– число электронов, участвующих в элементарной реакции;
С(Ox) и С(Red) – молярные концентрации окисленной (oxidation) и восстановленной (redaction) форм веществ, составляющий полуэлемент;
x, y – соответствующие им стехиометрические коэффициенты в уравнении реакции.
При подстановке в уравнение (12.1) Т = 298 К, F= 96500 Кл/моль,R= 8,31 Дж/моль·К и заменеlnlgдля гомогенной окислительно-восстановительной системы
х Ox+neyRed
получим следующее уравнение:
|
Е = Е0+ |
(12.2) |
Если в равновесии участвуют газообразные вещества, то молярные их концентрации можно заменить на парциальные давления. Твердые вещества (например, металлы) в уравнение Нернста не включают.
Величина электродного потенциала – это количественная характеристика окислительно-восстановительных свойств веществ:
Чем больше алгебраическая величина электродного потенциала, тем большими окислительными свойствами обладает окисленная форма и тем меньшими восстановительными – восстановленная форма вещества.
Уравнение Нернста для водородного
электрода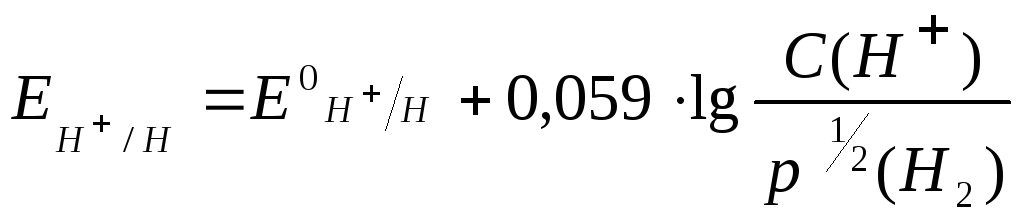
При нормальном давлении (p= 1 атм) это уравнение преобразуется в
следующее:![]()
Учитывая,
что стандартный потенциал водородного
электрода
![]() приняли равным нулю, а также то, что
–lgC(H+)
= pH,
получим зависимость
водородного электрода от pH
приняли равным нулю, а также то, что
–lgC(H+)
= pH,
получим зависимость
водородного электрода от pH
|
|
(12.3) |
При pH= 7:![]() =
– 0,059pH = – 0,059·7 = –
0,41B
=
– 0,059pH = – 0,059·7 = –
0,41B