
- •«Основы химической термодинамики, химической кинетики и равновесия» Основы химической термодинамики
- •1) При нагревании растет, при конденсации уменьшается;
- •4) Свободную энергию Гиббса.
- •1) Процесс неосуществим при любых температурах;
- •Коллигативные свойства
- •3) Числа частиц растворённого вещества
- •2) Не будут, т. К. Различны их молярные концентрации в растворевследствие отличия молярных масс
- •1) Понижается
- •4128 Ммоль;
- •25 Г соли, 475 г воды;
- •300 Мг, алиментарным путем;
- •2) Устойчивые в присутствии стабилизатора;
- •1) Эффектом Тиндаля;
- •1) Гранула и диффузный слой;
- •2) Разность потенциалов, возникающая на концах капиллярной системы при протекании через нее жидкой дс;
- •2) Диализом;
- •2) Шульце-Гарди;
- •1) Заряд которого противоположен заряду гранулы;
- •3) Больше его заряд;
- •2) Невидимые вооруженным глазом;
- •1) Максимальная концентрация коллоидного пав, при которой образуются мицеллы;
- •1) Минимальна;
- •1) Уменьшается;
- •2) Марка-Хаувинка;
- •2) Штаудингера;
- •4) Коацервацией.
- •1) Белков;
- •1) Желатинирование;
- •1) Синерезис;
- •2) Высаливание;
- •1) Гелей;
- •2) Коллоидная защита;
- •1) Повышается;
- •1) Первичная;
- •«Введение в общую химию.
- •Химия и медицина.
- •Основы количественного анализа»
- •Итоговое тестирование
- •1.Кинетика и катализ.
- •2.Термодинамика.
- •3.Коллигативные свойства растворов.
- •4. Титриметрический анализ. Протолитические реакции. Теория Бренстеда и Лоури.
- •5.Буферные растворы или протолитические равновесия и процессы.
- •6.Гетерогенные равновесия и процессы.
- •7. Лигандообменные равновесия и процессы.
- •8. Окислительно-восстановительные равновесия и процессы.
- •9. Физическая химия поверхностных явлений.
- •10. Физическая химия коллоидно-дисперсных систем.
- •11. Свойства растворов высокомолекулярных соединений ( вмс).
- •12. Гетерофункциональные соединения – метаболиты и биорегуляторы. Стереоизометрия.
- •13. Биологически активные гетероциклические соединения.
- •Микрогетерогенные системы
- •Химическое равновесие.
- •Химическая кинетика.
- •1 Порядка;
- •23. Выберите верное утверждение:
- •32. Активированный уголь — гидрофобный сорбент и лучше адсорбирует:
- •3) На силикагеле;
- •2) Чем больше длина углеводородного радикала н меньше полярность, тем больше поверхностная активность;
Химическое равновесие.
Какое утверждение справедливо: а) в состоянии химического равновесия концентрация исходных веществ и продуктов реакции со временем не изменяются; б) при равновесии масса исходных веществ всегда равна массе продуктов; в) при равновесии никакие химические реакции в системе не протекают; г) в состоянии равновесия всегда равны концентрации исходных веществ и продуктов.
а
Закон, определяющий соотношение между равновесными концентрациями, называется:
законом сохранения масс;
законом Рауля;
законом Вант-Гоффа.
Чтобы записать выражение для константы равновесия, необходимо знать:
полное стехиометрическое уравнение реакции;
механизмы прямой и обратной реакции;
изменение энтальпии для реакции;
кинетические уравнения для прямой и обратной реакции.
Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций:
введение катализатора,
изменение концентраций реагирующих веществ,
изменение температуры.
введение катализатора и повышение температуры.
Какие из перечисленных факторов влияют на константу равновесия реакции, если она протекает между веществами в газообразном состоянии: а)Р, б) Т, в) присутствие инертного газа, г) природа реагирующих, д) парциальные давления взятых для реакции веществ.
а, б, в, г.
б, г.
а, в, д
б, г, д
Изменится ли и как значение константы равновесия реакции: А +2В↔АВ2, если общее давление в системе увеличить в 2 раза? Все вещества находятся в газообразном состоянии.
увеличится в 4 раза,
увеличится в 2 раза,
уменьшится в 4 раза,
не изменится
Если система находится в состоянии равновесия, то какое из следующих утверждений является верным:
∆G =0,
К=1
К›1
К‹1
При каком соотношении ∆Н и Т ∆S система находится в равновесии:
∆Н = -T∆S;
∆Н › -T∆S;
∆Н ‹ -T∆S;
∆Н = T∆S;
Для некоторой реакции ∆G›0. Какие из приведенных утверждений правильны: а) К›1, б) К‹1, в) в равновесной смеси преобладают продукты реакции, г) в равновесной смеси преобладают исходные вещества.
а, в
б, г
а, г
а, б
Для некоторой реакции ∆G‹0. . Какие из приведенных утверждений правильны: а) К›1, б) К‹1, в) в равновесной смеси преобладают исходные вещества, г) в равновесной смеси преобладают продукты реакции.
а, г
а, в
б, в
б, г
Как изменится энтропия изолированной системы, в которой обратимо кристаллизуются вещества?
увеличится,
уменьшится,
не меняется,
достигает максимального значения.
Влияние различных факторов на химическое равновесие определяет:
принцип Ле-Шателье,
константа химического равновесия,
закон действующих масс,
закон Вант-Гоффа.
Какие факторы влияют на смещение химического равновесия, если реакция протекает в жидкой фазе: а) концентрации реагирующих веществ, б) давление, в) температура, г) время, д) катализатор?
а, б, в,
а, в,
а, в, г, д;
а, б, в, д.
Какие воздействия на систему 2SO2(г)+O2(г)↔ 2SO3(г)уменьшают выход продукта реакции: а) увеличение концентрации O2, б) увеличение концентрации SO3, в) повышение давления, г) возрастание объема реакционного сосуда.
б, г;
а, в;
б, в, г;
а, в, г.
В каком направлении сместится равновесие в системе 4Fe + 3O2↔2Fe2O3 при увеличения давления?
в сторону прямой реакции;
не сместится;
в сторону обратной реакции;
в сторону увеличения давления.
В какую сторону будет смещаться равновесие при повышении температуры в системе: N2(г)+3H2(г)↔2NH3(г), ∆Н‹0?
влево;
вправо;
не сместится;
в сторону эндотермической реакции.
В каких из ниже приведенных реакций изменение давления не вызовет нарушения равновесия: а) H2(г)+I2(г)↔2HI(г); б) 2SO2(г)+O2(г)↔ 2SO3(г); в) 4HCl(г)+ O2(г)↔2H2O(г)+ 2Cl2(г)?
в, б;
а, г;
а, б;
б, г.
Если объем закрытого реакционного сосуда, в котором установилось равновесие 2SO2(г)+O2(г)↔ 2SO3(г), уменьшить в 2 раза, то..э
равновесие не сместится,
равновесие сместится влево;
равновесие сместится вправо;
недостаточно данных для ответа.
Вследствие каких реакций повышение температуры и давления приведет к смещению равновесия вправо: а) 3О2(г)↔2О3(г), ∆Н298= 184,6кДж; б) N2(г)+ O2(г)=2NO, ∆Н=180,7 кДж; в) COCl2(г)↔CO(г)+Cl2(г), ∆H= 112,5 кДж; г) 2CO(г)↔ CO2(г)+С(г), ∆H=-172,5 кДж; д) CO2(г)+ 2H2(г)↔СH3OH(г), ∆H=193,3кДж.
а, д;
а, б, в, д;
а, д;
а, г, д.
В каком направлении сместиться равновесие в системе Hb+O2↔ Hb O2, при увеличении парциального давления кислорода?
в сторону прямой реакции;
равновесие не сместится;
в сторону обратной реакции;
в сторону увеличения давления.
Биохимическое равновесное состояние системы характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
в, г;
а, в;
б, г;
а, б.
стационарное состояние для живого организма характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
в, г;
а, в;
б, г;
а, б.
Условия химического равновесия:
∆G=0; Ѵ→=Ѵ←;
∆G=0; Ѵ→›Ѵ←;
∆G=DGmin+; Ѵ→=Ѵ←;
∆G=DGmin+; Ѵ→‹Ѵ←.
Для открытых систем стационарное состояние характеризуется приростом энтропии в единицу времени, которое:
 =0;
=0;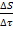 ›0;
›0; ‹0;
‹0;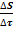 →min;
→min;
Биологические системы в стационарном состоянии характеризуются тем, что:
далеки от равновесия;
близки к равновесию;
близки к равновесию;
далеки от равновесия.
В соответствии с принципом Пригожина для стационарного состояния рассеяние энергии Гиббса открытой системой:
равно нулю;
максимально;
минимально;
не происходит.
Несколько одновременно существующих равновесий можно рассматривать как изолированные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение в других.
в, г;
а, б;
а, г;
а, в.
Несколько одновременно существующих равновесий можно рассматривать как совмещенные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение в других.
в, г;
а, б;
а, г;
а, в.
В биологических системах протекают совмещенные равновесия, в которых преобладающим становится процесс, характеризующийся:
большим значением константы равновесия, т.е. меньшей убылью энергии Гиббса;
меньшим значением константы равновесия, т.е. меньшей убылью энергии Гиббса;
большим значением константы равновесия, т.е. большей убылью энергии Гиббса;
меньшим значением константы равновесия, т.е. большей убылью энергии Гиббса.
Гидроксид алюминия – антацидное вещество, снижение кислотности желудочного сока обусловлено реакцией: Al(OH)3+H+↔ Al(OH)+H2O. Растворение прекращается при pH=4. Укажите преобладающий конкурирующий процесс: а) при pH‹4 преобладает протолитическое равновесие; б) при pH›4 преобладает гетерогенное равновесие; в) при pH›4 преобладает протолитическое равновесие; г) при pH‹7 преобладает гетерогенное равновесие.
а, б;
в, г;
а, г;
б, в.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
|
3 |
3 |
4 |
3 |
2 |
4 |
1 |
4 |
2 |
1 |
3 |
1 |
2 |
1 |
1 |
1 |
2 |
3 |
1 |
|
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
|
|
|
|
|
|
|
|
3 |
4 |
1 |
1 |
4 |
1 |
3 |
2 |
1 |
3 |
1 |
|
|
|
|
|
|
|
|
