
- •Военно-медицинская академия имени с. М. Кирова военная токсикология, радиобиология и медицинская защита
- •Рекомендуется Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
- •Печатается согласно редакционно-иэдательскону плану Военно-медицинской академии имени с. М. Кирова, утвержденному начальником Главного военно-медицинского управления Министерства обороны рф
- •Оглавление
- •Часть I токсикология
- •Раздел I. Общая токсикология
- •Глава 1. Предмет, цель, задачи и структура токсикологии
- •Глава 2. Основные понятия токсикологии
- •Часть I. Luiwnisujiwi nn
- •Часть I. I wivwnivwjivi ил
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Глава 3. Токсикометрия
- •Основные значения ответа группы на токсикант сосредоточены вокруг среднего значения
- •Влияние способа введения на токсичность зарина и атропина для лабораторных животных
- •Глава 3. Токсикометрия
- •Глава 4. Токсикокинетика
- •Характеристики различных биологических барьеров
- •Признаки специфического транспорта
- •Примеры биотрансформации ксенобиотиков с образованием активных промежуточных продуктов в ходе I фазы метаболизма
- •Глава 4. Токсикокинетика
- •А. Реакции, протекающие при участии активированных форм присоединяемых агентов
- •Дальнейший метаболизм экскреция
- •Глава 5. Токсикодинамика
- •Глава 5. Юкиикидиндми
- •5.214. Нарушение гомеостаза внутриклеточного кальция
- •Глава 6. Антидоты. Общие принципы оказания неотложной помощи отравленным
- •Глава 7. Основные понятия военной токсикологии
- •Глава 8. Отравляющие и высокотоксичные вещества раздражающего действия
- •8.Ц. Основные проявления поражения
- •Глава 9. Отравляющие и высокотоксичные вещества пульмонотоксического действия
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •Кофактор
- •Диметиламинфенол
- •Способность некоторых ароматических аминов вызывать образование метгемоглобина у разных экспериментальных животных
- •Глава 11. Отравляющие и высокотоксичные вещества цитотоксического действия
- •Сравнительная характеристика поражения кожи люизитом и ипритом
- •Основные свойства фенилдихлорарсина
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Унитиол
- •Глава 12. Отравляющие и высокотоксичные вещества нейротоксического действия
- •Предполагаемые потери живой силы в районе применения отравляющего вещества VX из выливных авиационных приборов, % (по в. В. Мясникову, 1989)
- •Вещества нервно-паралитического действия
- •Классификация нервно-паралитических овтв в соответствии с особенностями их токсического действия на организм
- •Возможные общие механизмы генерации судорожного синдрома
- •Классификация нервно-паралитических овтв в соответствии с механизмами токсического действия на организм
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •100 Дней; pH 13 — 16 мин, pH 14 — 1,3 мин
- •006 Г/человека
- •Признаки острого поражения фос и механизмы их развития
- •Основные направления разработки средств медицинской защиты от фосфорорганических отравляющих веществ (по с. Н. Голикову и соавт., 1972)
- •Норборнан
- •Дисульфотетразоадамантан
- •Распределение ионов внутри и вне возбудимых клеток, мМ/л (по Katz, 1971)
- •Степени тяжести и фазы течения интоксикаций атропиноподобными препаратами (по с. С. Крылову и соавт., 1999)
- •Глава 13. Предмет, цель и задачи радиобиологии
- •Глава 14. Виды ионизирующих излучений и их свойства
- •Относительная биологическая эффективность ионизирующих излучений для клеток
- •Ориентировочные значения поглощенной дозы излучения при некоторых медицинских процедурах
- •Глава 15. Радионуклиды как источник радиационной опасности
- •Глава 16.
- •Нестохастические эффекты
- •Стохастические эффекты
- •Глава 17. Факторы, вызывающие поражения личного состава войск при ядерных взрывах и радиационных авариях
- •Глава 18. Лучевые поражения в результате внешнего облучения
- •Глава 19. Лучевые поражения в результате общего (тотального)облучения
- •Реконструкция дозы общего однократного равномерного внешнего у-облучения организма по некоторым проявлениям поражения в период общей первичной реакции на облучение
- •Глава 20. Медицинская защита от внешнего облучения
- •Фид Cfls° с пРепаРатом (опыт)
- •Глава 21.
- •Глава 22. Поражения в результате внутреннего радиоактивного заражения
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Ожидаемая частота и характеристика радиационно индуцированной эметической реакции при комбинированных радиационных поражениях (по Бритуну а. И. И др., 1992)
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •И объема первой помощи
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 25. Специальная обработка в подразделениях и частнх медицинскои службы
- •Глава 25. Специальная обработка в подказдьльнинх и чашНл мьдициникии службы
- •Глава 25. Специальная обработка в подразделениях и частях медицинскои службы
- •Глава 26. Радиационная и химическая разведка в частях и подразделениях медицинской службы
- •26.1. Средства и методы радиационной разведки и контроля
- •26Д. Организация и проведение контроля доз облучения личного состава, раненых и больных на этапах медицинской эвакуации
- •26.5. Организация и проведение экспертизы воды и продовольствия на зараженность отравляющими, высокотоксичными и радиоактивными веществами
- •Учебное издание
- •Учебник Под редакцией профессора с. А. Куценко
- •190020, Санкт-Петербург, Нарвский пр., 18, оф. 501 тел./факс: (812) 325-39-86, 186-72-36 e-mail: foliant@peterlink. Ru
CH2-SH
CH—SH
I
CH2-S03NaУнитиол
CH2-SH
I
сн—sh I
сн2-он
димеркаптопропанол
NaOOCCH — CHCOONa I I SH SH
димеркаптосукцинат
CH, NH,
I I H3CC—CCOOH I
SH
d-пенициламин
Puc. 39. Структуры некоторых комплексообразователей из групп ди- и монотиолов
В нашей стране профессором А. И. Черкесом с соавторами был разработан антидот 2,3-димеркаптопропансульфонат натрия (унитиол), тоже относящийся к группе дитиолов, лишенный недостатков БАЛ. Это вещество хорошо растворимо в воде. Широта терапевтического действия — 1:20. Унитиол, так же как БАЛ, взаимодействует в крови и тканях отравленного и со свободным люизитом, и с ядом, уже связавшимся с молекулами-мишенями. Комплекс «люизит-унитиол», называемый тиоарсени- том, малотоксичен, хорошо растворим в воде и легко выводится из организма с мочой. Под влиянием унитиола у отравленных нормализуется состояние сердечно-сосудистой системы и системы крови: восстанавливается уровень кровяного давления, коллапс и сгущение крови, как правило, не развиваются. Отмечается нормализация биохимических показателей. Лечебная эффективность антидота в известной мере определяется сроками начала лечения. Наилучшие результаты наблюдались при введении вещества в течение первых 0,5—1 ч после отравления мышьяком. Однако введение унитиола и через 4—6 ч после отравления обеспечивает выживание экспериментальных животных, отравленных абсолютно смертельными дозами яда.
Унитиол выпускается в ампулах по 5 мл 5% водного раствора. Поскольку после введения унитиол определяется в крови в течение лишь 5 ч, при отравлениях соединениями мышьяка его вводят подкожно или внутримышечно по следующей схеме: в 1-е сут — по 1 ампуле 4—6 раз с интервалом 4—6 ч; во 2-е — 3-и сут — по 1 ампуле 2—3 раза с интервалом 8—12 ч; в последующие 4—5-е сут — по 1 ампуле в сутки.
К числу достаточно эффективных препаратов относят димеркапто- сукцинат (ДМС). В эксперименте вещество оказалось весьма эффективным при острых интоксикациях As. Препарат является менее токсичным, чем БАЛ.
Д-пенициламин (ipynna монотиолов) образует менее прочные комплексы с металлом, чем дитиолы, но в отличие от последних хорошо всасывается в желудочно-кишечном тракте и потому может быть назначен через рот.
Необходимо отметить, что применение специфических противоядий (дитиолов) при отравлениях соединениями мышьяка не всегда устраняет симптомы интоксикации. Достаточно резистентными оказываются нарушения со стороны ЦНС, обмена веществ при тяжелых формах отравления, а также в случае применения антидота в поздние периоды интоксикации. Поэтому при оказании медицинской помощи отравленным мышьяксодержащими веществами следует широко использовать и симптоматические средства терапии. Важнейшим направлением оказания помощи является борьба с развивающейся острой сердечно-сосуди- стой недостаточностью.
11.3* Токсичные модификаторы пластического обмена
В ipynne ОВТВ к числу токсичных модификаторов пластического обмена принадлежат полигалогенированные ароматические углеводороды (ПАУ), среди которых наибольшей биологической активностью обладают диоксин и диоксиноподобные вещества. Вероятность острого поражения ПАУ в ходе военных конфликтов невелика, но их достаточно высокая токсичность, стойкость в окружающей среде, способность к длительной материальной кумуляции, а также особенности развивающегося токсического процесса позволяют отнести эти соединения к числу высокоопасных и требующих к себе особого внимания со стороны военных специалистов.
С позиций военной токсикологии, наиболее опасными веществами из группы полигалогенированных ароматических углеводородов являются галогенированные диоксины, дибензофураны и бифенилы.
Соединения, содержащие в молекуле различное количество атомов галогенов (преимущественно хлора или брома), два бензольных кольца и один атом кислорода, называют галогенированными дибензофуранами; два атома кислорода — диоксинами; если вещества не содержат кислорода — это галогенированные бифенилы (рис. 40). Атомы галогенов замешают один и более атомов водорода, входящих в структуру бензольных колец.
![]()
О О'
бифенил бензофуран диоксин
Рис. 40. Структуры молекул некоторых полициклических углеводородов
Хлорированные соединения могут образовываться при взаимодействии хлора с ароматическими углеводородами в кислородной среде, в частности, при хлорировании питьевой воды. К другим источникам веществ в окружающей среде относятся: термическое разложение различных химических продуктов, сжигание осадков сточных вод и других отходов, металлообрабатывающая и металлургическая промышленность, выхлопные газы автомобилей, возгорание электрического оборудования, лесные пожары, а также производство и широкое применение некоторых видов пестицидов, прежде всего галогенпроизводных феноксиуксусной кислоты (2,4-дихлорфеноксиуксусной и 2,4,5-трихлорфеноксиуксусной кислот).
11.3.1 Диоксины
Разнообразие химической структуры диоксинов определяется типом галогена (хлор или бром), числом его атомов в молекуле и возможностью изомерии (положение галогенов в молекуле). В настоящее время насчитывается несколько десятков семейств этих ядов, а общее число соединений превышает тысячу.
тетрахлордибензо-пара-диоксин (ТХДД) — самый токсичный представитель группы. Вещество в относительно большом количестве образуется как побочный продукт в процессе синтеза 2,4,5-трихлорфеноксиуксусной кислоты и трихлорфенола.
Первые сообщения о высокой токсичности ТХДД появились в 1957 г. Во второй половине XX столетия зарегистрированы более 200 аварий и инцидентов на предприятиях по производству хлорированных фенолов, при которых отмечался выброс в окружающую среду среди прочих веществ и 2,3,7,8-ТХДЦ. За последние 40 лет в результате аварий на таких производствах пострадало более 1500 человек. Необычайная биологическая активность диоксина подтвердилась в результате ретроспективного эпидемиологического анализа аварий.
В начале 70-х гг. XX в. интерес к веществу существенно возрос в связи с ухудшением здоровья населения некоторых регионов Южного Вьетнама, а также военнослужащих армии США, принимавших участие в боевых действиях против вьетнамской армии, в ходе которых в качестве средства борьбы с растениями применяли так называемую «оранжевую
смесь». Основным компонентом этой смеси являлась 2,4,5-трихлорфе- ноксиуксусная кислота, а в качестве примеси присутствовал диоксин. Всего в ходе войны американцы и их союзники применили не менее 100 тыс. тонн гербицидов. При этом в окружающую среду поступило (по расчетам) примерно 200—500 кг диоксина.
Физико-химические свойства. Токсичность
ТХДД представляет собой кристаллическое вещество с молекулярной массой около 320 дальтон; температура кипения: 305° С. Хорошо растворяется в органических растворителях, особенно в о-хлорбензоле. В воде не растворим. Отличается высокой липофильностью. Способность к испарению крайне низка. Вещество отличается необычайной стойкостью, накапливается в объектах внешней среды, организмах животных, передается по пищевым цепям. Во внешней среде диоксины абсорбируются на органических, пылевых и аэрозольных частицах, разносятся воздушными потоками, поступают в водные экосистемы. В донных отложениях стоячих водоемов яд может сохраняться десятки лет. В почве возможна медленная микробная деградация диоксина. Период полуэли- минации из почвы составляет 1—1,5 года. По другим данным, этот срок значительно больше (около 10 лет), что определяется конкретными кли- мато-географическими условиями и характером почвы. Яд отнесён к числу «суперэкотоксикантов».
При оценке токсичности 2,3,7,8-тетрахлордибензо-пара-диоксина выявляются значительные межвидовые различия (табл. 37).
■т
Токсичность диоксина для разных видов животных при внутрибрюшинном введении
|
Вид животного |
LD50, мкг/кг |
|
Морская свинка |
0,6-2,5. |
|
Крыса |
22-45 |
|
Обезьяна |
менее 70 |
|
Кролик |
115-275 |
|
Мышь |
114-280 |
|
Собака |
менее 300 |
|
Лягушка-бык |
менее 500 |
|
Хомяк |
5000 |
По существующим оценкам, токсичность ТХДД для человека сопоставима с таковой для приматов.
Токсикокинетика
Основные пути поступления диоксинов в организм — с зараженной пищей и ингаляционно в форме аэрозоля. После поступления в кровь вещества распределяются в органах и тканях. Значительная часть токсикан-
Таблица 37тов кумулируется в богатых липидами тканях и прежде всего в жировой. Даже через 15 лет после окончания химической войны содержание ТХДД в жировой ткани жителей ряда районов Вьетнама было в 3—4 раза выше, чем у жителей Европы и США.
Вещество медленно метаболизирует в организме, в основном в печени и почках, при участии цитохром-Р-450-зависимых оксидаз. 2,3,7,8-тет- рахлордибензо-пара-диоксин не только сам разрушается при участии оксидаз смешанной функции, но и существенно активирует метаболизм других ксенобиотиков. Диоксин — один из самых мощных индукторов микросомальных ферментов. С этим свойством вещества связывают механизм его токсического действия на организм. Достаточно точно установлен период полувыведения 2,3,7,8 — ТХДД. У человека он составляет 2120 дней (по другим данным — 5—7 лет); у крысы — 30 дней; морской свинки — 30—94; обезьяны — 455.
Основные проявления острой интоксикации
Характерна большая отероченность в развитии токсических эффектов диоксина. Гибель животных (даже грызунов) наступает спустя 3 и более недель после внутрибрюшинного введения яда в летальных дозах. Крупные животные погибают в более поздние сроки, чем мелкие. В клинической картине смертельного поражения вначале преобладают симптомы общей интоксикации (истощение, анорексия, общее угнетение, адинамия, эозинопения, лимфопения, лейкоцитоз с нейтрофиле- зом). Позднее присоединяются симптомы органоспецифической патологии (поражения печени, тканей иммунокомпетентных систем), проявления панцитопенического синдрома и др. Характерным признаком интоксикации являются отеки. Жидкость накапливается в подкожной клетчатке сначала вокруг глаз, затем отеки распространяются на лицо, шею, туловище. Характерны тяжелейшие терминальные отеки, в основном подкожной локализации, однако жидкость обнаруживается также в грудной, брюшной полостях, полости перикарда. Иногда наблюдается умеренный отек легких.
При несмертельных острых поражениях людей диоксином токсический процесс растягивается на многие месяцы, а иногда и годы.
Проявления интоксикации характеризуются нарушением обмена веществ, патологическими изменениями энтодермальных и эктодермальных тканей (эпителия желудочно-кишечного тракта и печени; кожи и придатков кожи), атрофией лимфоидной ткани, нарушениями функций нервной системы и эндокринных желез (щитовидной, поджелудочной, половых желез).
За период диоксиновой болезни отравленные теряют в весе до 1/3 массы тела. Этому способствует выраженная анорексия, резкое сокращение потребления воды.
При отравлениях легкой степени у людей наиболее ранним и наиболее частым признаком поражения является трансформация клеток сальных желез с формированием «хлоракне».
Нередко это единственный эквивалент токсического воздействия диоксина. Вначале на коже лица с нижней и наружной стороны глаз, а также на непокрытой волосами коже за ушами появляются мелкая сыпь зуд (у пострадавших в Южном Вьетнаме это происходило в течение пер вых 6 мес после поражения). Затем волосяные фолликулы расширяютс" их содержимое темнеет. Кожа носа и подбородка чаше остается непор женной. Появление хлоракне на коже щек, лба, шеи, гениталий, плеч, груди, спины свидетельствует о более тяжелом поражении. Процесс может продолжаться длительно, особенно в условиях подострого и хронического действия диоксина. По-видимому, минимальный срок сохранения развившихся хлоракне — 10 лет. Через 15—20 лет после поражения признаки хлоракне в активной форме или в виде остаточных рубцов выявляются приблизительно у четверти людей, имевших хлоракне в течение первого года. Одной из причин развивающегося эффекта считают глубокое нарушение обмена липидов и жирорастворимых веществ у отравленных, в частности витамина А и др.
Помимо хлоракне развиваются чешуйчатая метаплазия кератиноци- тов, проявляющаяся гиперкератозом кожи стоп и ладоней, гипоплазия и деформация ногтей (разрушаются ногти на пальцах рук и ног), выпадают волосы и ресницы. Развивается стойкий блефарит.
Важным проявлением интоксикации является поражение печени: жировое перерождение, очаговый центролобулярный некроз, пролиферация эпителия желчных путей и желчного пузыря. Гисгохимически выявляется полное подавление АТФ-азной активности гепатоцитов, что свидетельствует о повреждении плазматической мембраны клеток печени. Нарушаются обмен жирорастворимых витаминов, порфириновый обмен. Развивается гипербилирубинемия.
Характерно иммунотоксическое действие диоксина. При этом количество лимфоцитов в периферической крови у взрослых людей изменяется мало, однако резко падает содержание а-, р-, у-глобулинов, подавляются реакции клеточного иммунитета.
Нарушения со стороны центральной нервной системы проявляются выраженной депрессией. Пораженный становится вялым, малоподвижным. Характерны сонливость, головная боль, пробелы в памяти. Возможны суицидные попытки.
Неблагоприятной особенностью токсического действия диоксинов является наличие «отложенных эффектов», когда симптомы поражения развиваются спустя год и более после воздействия яда.
Диоксин обладает эмбриотоксическим и тератогенным действием. Так, у жителей Южного Вьетнама, проживающих на зараженных территориях, частота самопроизвольных абортов возросла в 2,2—2,9 раз, частота врожденных пороков развития — в 12,7 раз.
Специалистами МАИР (Международной ассоциации исследований рака) диоксин отнесен к числу соединений, канцерогенных для человека.
11.3.2. Полихлорированные бифенилы (ПХБ)
Рис.
41.
Структура одного из изомеров
полихлорированных бифенилов![]()
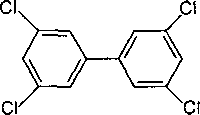
Хлор может замещать атомы водорода при любом атоме углерода. На рис. 41 представлена структура 3,5,3*,5*-тетрахлорбифенила. Теоретически возможно существование 209 изомеров вещества.
ПХБ при остром воздействии обладают сравнительно низкой токсичностью. Сравнительное изучение изомеров показывает, что хлорзаме- щенные в мета- и пара-положении более токсичны.
Средняя смертельная доза колеблется в интервале от 0,5 до 11,3 г/кг в зависимости от строения изомера и вида экспериментального животного.
ПХБ широко использовались при производстве электрооборудования, в частности трансформаторов и усилителей, а также в качестве наполнителей при производстве красителей и пестицидов, смазочных материалов для турбин, для производства гидравлических систем, текстиля, бумаги, флуоресцентных ламп, телевизионных приемников и др. Такое широкое использование ПХБ было обусловлено их высокой термостойкостью, химической стабильностью, диэлектрическими свойствами, что позволяло применять вещества для производства изделий, в которых применение других охлаждающих агентов было сопряжено с высокой опасностью взрывов или воспламенения.
В 70-е гг. XX в. в лабораторных и натурных исследованиях была установлена высокая опасность этих веществ, обусловленная способностью персистировать в окружающей среде и токсичностью для лабораторных животных. В 1979 г. производство веществ в США было запрещено.
Токсикокинетика
В организм ПХБ могут проникать через кожу, легкие и желудочно- кишечный тракт. На производстве основной способ поступления веществ — через кожные покровы, в то время как в повседневной жизни большее количество веществ поступает в организм с контаминированной пищей.
Попав в кровь, вещества быстро накапливаются в печени и мышцах, откуда затем перераспредляются в жировую ткань. Коэффициент распределения веществ в мозге : печени : жире составляет в среднем — 1 : 3,5 : 81.
Среднее содержание ПХБ в сыворотке крови людей, проживающих в «чистых» регионах, составляет примерно 7 частей на миллиард, у лиц, профессионально контактирующих с ПХБ, — может достигать 3300.
ПХБ метаболизируют в основном в печени с образованием гидрокси- лированных фенольных соединений, через промежуточный продукт — ареноксид. Возможно дегалогенирование соединений. Скорость метабо лизма зависит от структуры изомера и вида экспериментального живот ного, на котором изучается процесс. Собаки и грызуны метаболизирую ПХБ с большей скоростью, чем приматы. Основные пути выведения: р желчью в содержимое кишечника и через почки с мочой.
Как и диоксины, ПХБ являются индукторами Р-450-зависимых оксИ|- даз смешанной функции в печени, легких и тонком кишечнике. Их введение в организм сопровождается усилением метаболизма других ксенобиотиков. Индукторная способность различных изомеров ПХБ неодинакова.
Степень депонирования веществ в тканях зависит от строения изомеров, пути и продолжительности проникновения их в организм, а также от пола, возраста, привычек человека (приема алкоголя). Период полувыве- дения из организма колеблется от 6—7 до 33—34 мес.
Основные проявления острой интоксикации
Проявления интоксикации ПХБ чрезвычайно напоминают эффекты, развивающиеся при отравлении диоксинами.
В эксперименте на животных подострые и хронические воздействия приводят к развитию многообразных эффектов: прогрессивному падению веса, хлоракне, выпадению волос, отекам, инволюции тимуса и лимфоидной ткани, гепатомегалии, угнетению костного мозга, нарушению репродуктивных функций. У животных, подвергшихся воздействию ПХБ в пренатальном, неонатальном и постнатальном периоде, развиваются неврологические знаки, проявляющиеся главным образом нарушением поведения: склонностью к стереотипным «манежным» движениям, ги- пер- или гипоактивностью. У взрослых животных нейротоксические свойства веществ не выявляются.
В действующих дозах вещества вызывают понижение веса иммуноком- петентных органов, включая селезенку, тимус, лимфатические узлы. Функциональное состояние иммунной системы не однозначно: при действии высоких доз ПХБ отмечается иммуносупрессивное (снижение уровня антител, особенно IgA, IgM), а малых — активирующее (повышение уровня IgG) состояние. Имеются данные об увеличении частоты инфекционных заболеваний среди животных, подвергшихся воздействию ПХБ.
Получены многочисленные данные, свидетельствующие о мутагенном и канцерогенном действии ПХБ.
Токсический процесс, вызываемый ПХБ у человека, изучен недостаточно. Наиболее достоверным эффектом является патология кожных покровов, и в частности, хлоракне (см. 11.3.1. «Диоксины»). В некоторых исследованиях выявлена связь между действием ПХБ и развитием таких общих неблагоприятных эффектов, как частая головная боль, утомляемость, нервозность.
Механизм токсического действия полигалогенированных ароматических углеводородов
![]() 1
Токсическое действие полигалогенированных
ароматических углеводородов в
настоящее время во многом связывают с
их чрезвычайно высокой активностью как
индукторов ферментов гладкого
эндоплазматического ретикулума печени,
почек, легких, кожи и других органов
(микросомаль- ных ферментов), участвующих
в метаболизме чужеродных соединений и
некоторых эндогенных веществ.
2,3,7,8-Тетрахлордибензо-пара-диоксин
(ТХДЦ) является самым сильным из известных
индукторов, в частности, монооксигеназ.
Его эффективная доза составляет 1 мкг/кг
массы (в подавляющем большинстве
случаев другие ксенобиотики проявляют
свойства индукторов данной группы
энзимов, действуя в значительно больших
дозах — более 10
мг/кг).
1
Токсическое действие полигалогенированных
ароматических углеводородов в
настоящее время во многом связывают с
их чрезвычайно высокой активностью как
индукторов ферментов гладкого
эндоплазматического ретикулума печени,
почек, легких, кожи и других органов
(микросомаль- ных ферментов), участвующих
в метаболизме чужеродных соединений и
некоторых эндогенных веществ.
2,3,7,8-Тетрахлордибензо-пара-диоксин
(ТХДЦ) является самым сильным из известных
индукторов, в частности, монооксигеназ.
Его эффективная доза составляет 1 мкг/кг
массы (в подавляющем большинстве
случаев другие ксенобиотики проявляют
свойства индукторов данной группы
энзимов, действуя в значительно больших
дозах — более 10
мг/кг).
Индукция активности предполагает синтез дополнительного количества того или иного энзима (белка) в органах и тканях de novo. Поскольку блокаторы синтеза ДНК (гидроксимочевина) не препятствуют индукции микросомальных энзимов диоксином и диоксиноподобными веществами, а ингибиторы синтеза РНК (актиномицин Д) и белка (пуромицин, цикло- гексимид) блокируют процесс, делается вывод, что феномен индукции реализуется на уровне транскрипции генетической информации клетки.
В соответствии с существующими представлениями, механизм действия ПАУ, и в частности ТХДЦ, состоит во взаимодействии вещества с цитозольными белками-регуляторами активности генов, отвечающих за синтез микросомальных ферментов. В норме, при поступлении ксенобиотиков в организм, а затем и в клетки (печени, почек и т. д.), они образуют в цитоплазме комплексы с белками-регуляторами, которые мигрируют в ядро клетки, где, взаимодействуя с ДНК, вызывают дерепрессию регуляторных генов и тем самым активируют синтез того или иного энзима. В случае ТХДЦ такой рецепторный цитоплазматический протеин-регулятор идентифицирован. В частности, установлено, что синтез гидроксила- зы ароматических улеводородов (aryl hydrocarbon hydroxylase) в гепатоци- тах мышей, чувствительных к ароматическим углеводородам, регулируется локусом единственного доминантного гена (обозначается — Ah) и может быть усилен при проникновении в ядро клетки образующегося в цитоплазме комплекса ТХДЦ с определенным протеином. Этот цитозольный белок-регулятор гена получил название Ah-рецепторный протеин.
Индукция, вызываемая полициклическими углеводородами, не сопровождается выраженной пролиферацией гладкого эндоплазматического ретикулума, но существенно возрастает активность Р-450-зависимых монооксигеназ, УДФГ-трансферазы, гидроксилаз и других энзимов.
Поскольку диоксин и диоксиноподобные вещества длительное время сохраняются в организме, наблюдается стойкая индукция микросомальных энзимов. При этом существенно изменяется не только скорость, но и характер биопревращений разнообразных чужеродных веществ, поступающих в организм (ксенобиотиков) и целого ряда эндогенных (прежде всего липо- фильных) биологически активных веществ, метаболизируемых при участии
этой группы энзимов. В частности, существенно модифицируется метаболизм стероидов, порфиринов и каротиноидов, к числу которых относятся многие гормоны, витамины, коферменты и структурные элементы клеток.
Стойкая активация диоксином биопревращения некоторых ксенобиотиков, поступающих в организм с водой, продовольствием, вдыхаемым воздухом, может приводить к усиленному образованию реактивных npo-f межуточных метаболитов и вторичному поражению ими различных органов и тканей. Модификация обмена стероидов (андрогенов, эстрогенов, анаболических стероидов, кортикосероидов, желчных кислот), порфиринов (простетические группы гемопротеинов, цитохромы, витамин В12 и т. д.), каротиноидов (витамины группы «А»), как известно, сопровождается выраженным нарушением обмена веществ. И тот и другой эффект, в сочетании, проявляются клинической картиной вялотекущего токсического процесса, описание которого дано выше.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
использование индивидуальных технических средств защиты (средства защиты кожи; средства защиты органов дыхания) в зоне химического заражения;
участие медицинской службы в проведении химической разведки в районе расположения войск, экспертиза воды и продовольствия на зараженность ОВТВ;
запрет на использование воды и продовольствия из непроверенных источников;
обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
своевременное выявление пораженных;
подготовка и проведение эвакуации.
Медицинские средства защиты
Поскольку клиническая картина острого поражения веществами развивается крайне замедленно, факт воздействия веществами, как правило, остается незамеченным. Основная задача медицинской службы в случае появления признаков поражения у отдельных военнослужащих сводится к организации тщательного наблюдения за состоянием здоровья всего личного состава подразделения, выявлению пораженных с признаками заболевания, снижающими их военно-профессиональную работоспособность, и их своевременной госпитализации.
Специфические антагонисты (антидоты) токсического действия по- лигалогенированных ароматических углеводородов отсутствуют.
