
- •Военно-медицинская академия имени с. М. Кирова военная токсикология, радиобиология и медицинская защита
- •Рекомендуется Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
- •Печатается согласно редакционно-иэдательскону плану Военно-медицинской академии имени с. М. Кирова, утвержденному начальником Главного военно-медицинского управления Министерства обороны рф
- •Оглавление
- •Часть I токсикология
- •Раздел I. Общая токсикология
- •Глава 1. Предмет, цель, задачи и структура токсикологии
- •Глава 2. Основные понятия токсикологии
- •Часть I. Luiwnisujiwi nn
- •Часть I. I wivwnivwjivi ил
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Глава 3. Токсикометрия
- •Основные значения ответа группы на токсикант сосредоточены вокруг среднего значения
- •Влияние способа введения на токсичность зарина и атропина для лабораторных животных
- •Глава 3. Токсикометрия
- •Глава 4. Токсикокинетика
- •Характеристики различных биологических барьеров
- •Признаки специфического транспорта
- •Примеры биотрансформации ксенобиотиков с образованием активных промежуточных продуктов в ходе I фазы метаболизма
- •Глава 4. Токсикокинетика
- •А. Реакции, протекающие при участии активированных форм присоединяемых агентов
- •Дальнейший метаболизм экскреция
- •Глава 5. Токсикодинамика
- •Глава 5. Юкиикидиндми
- •5.214. Нарушение гомеостаза внутриклеточного кальция
- •Глава 6. Антидоты. Общие принципы оказания неотложной помощи отравленным
- •Глава 7. Основные понятия военной токсикологии
- •Глава 8. Отравляющие и высокотоксичные вещества раздражающего действия
- •8.Ц. Основные проявления поражения
- •Глава 9. Отравляющие и высокотоксичные вещества пульмонотоксического действия
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •Кофактор
- •Диметиламинфенол
- •Способность некоторых ароматических аминов вызывать образование метгемоглобина у разных экспериментальных животных
- •Глава 11. Отравляющие и высокотоксичные вещества цитотоксического действия
- •Сравнительная характеристика поражения кожи люизитом и ипритом
- •Основные свойства фенилдихлорарсина
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Унитиол
- •Глава 12. Отравляющие и высокотоксичные вещества нейротоксического действия
- •Предполагаемые потери живой силы в районе применения отравляющего вещества VX из выливных авиационных приборов, % (по в. В. Мясникову, 1989)
- •Вещества нервно-паралитического действия
- •Классификация нервно-паралитических овтв в соответствии с особенностями их токсического действия на организм
- •Возможные общие механизмы генерации судорожного синдрома
- •Классификация нервно-паралитических овтв в соответствии с механизмами токсического действия на организм
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •100 Дней; pH 13 — 16 мин, pH 14 — 1,3 мин
- •006 Г/человека
- •Признаки острого поражения фос и механизмы их развития
- •Основные направления разработки средств медицинской защиты от фосфорорганических отравляющих веществ (по с. Н. Голикову и соавт., 1972)
- •Норборнан
- •Дисульфотетразоадамантан
- •Распределение ионов внутри и вне возбудимых клеток, мМ/л (по Katz, 1971)
- •Степени тяжести и фазы течения интоксикаций атропиноподобными препаратами (по с. С. Крылову и соавт., 1999)
- •Глава 13. Предмет, цель и задачи радиобиологии
- •Глава 14. Виды ионизирующих излучений и их свойства
- •Относительная биологическая эффективность ионизирующих излучений для клеток
- •Ориентировочные значения поглощенной дозы излучения при некоторых медицинских процедурах
- •Глава 15. Радионуклиды как источник радиационной опасности
- •Глава 16.
- •Нестохастические эффекты
- •Стохастические эффекты
- •Глава 17. Факторы, вызывающие поражения личного состава войск при ядерных взрывах и радиационных авариях
- •Глава 18. Лучевые поражения в результате внешнего облучения
- •Глава 19. Лучевые поражения в результате общего (тотального)облучения
- •Реконструкция дозы общего однократного равномерного внешнего у-облучения организма по некоторым проявлениям поражения в период общей первичной реакции на облучение
- •Глава 20. Медицинская защита от внешнего облучения
- •Фид Cfls° с пРепаРатом (опыт)
- •Глава 21.
- •Глава 22. Поражения в результате внутреннего радиоактивного заражения
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •Ожидаемая частота и характеристика радиационно индуцированной эметической реакции при комбинированных радиационных поражениях (по Бритуну а. И. И др., 1992)
- •Глава 1. Предмет, цель, задачи и структура токсикологии 21
- •И объема первой помощи
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 25. Специальная обработка в подразделениях и частнх медицинскои службы
- •Глава 25. Специальная обработка в подказдьльнинх и чашНл мьдициникии службы
- •Глава 25. Специальная обработка в подразделениях и частях медицинскои службы
- •Глава 26. Радиационная и химическая разведка в частях и подразделениях медицинской службы
- •26.1. Средства и методы радиационной разведки и контроля
- •26Д. Организация и проведение контроля доз облучения личного состава, раненых и больных на этапах медицинской эвакуации
- •26.5. Организация и проведение экспертизы воды и продовольствия на зараженность отравляющими, высокотоксичными и радиоактивными веществами
- •Учебное издание
- •Учебник Под редакцией профессора с. А. Куценко
- •190020, Санкт-Петербург, Нарвский пр., 18, оф. 501 тел./факс: (812) 325-39-86, 186-72-36 e-mail: foliant@peterlink. Ru
Глава 5. Юкиикидиндми
Содержание в клетке свободных радикалов жестко контролируется широким спектром как ферментативных, так и неферментативных механизмов антирадикальной защиты. Основными элементами ферментативной защиты являются: супероксиддисмутаза, каталаза, глутатион-пероксидаза, глутатион-редуктаза; неферментативной — а-токоферол, p-каротин, аскорбиновая кислота, восстановленный глутатион, мочевая кислота. Отдельные элементы системы защиты действуют комплексно и потенцируют эффект друг друга. Они локализуются либо в гидрофобных, либо гидрофильных компартментах клеток (например, токоферол — липофилен, глутатион, аскорбиновая кислота — гидрофильны). Результатом действия системы антирадикальной защиты клетки является превращение свободных радикалов в нереакционноспособные вещества. Однако если функционирование окислительно-восстановительного цикла превращения ксенобиотика, проникшего в организм в относительно высокой дозе, будет продолжаться в течение достаточно длительного времени, механизмы клеточной защиты могут истощиться и произойдет повреждение клетки.
Итогом такого действия являются изменение функционального состояния и гибель клетки, мутация ее генетического кода, что на уровне макроорганизма приводит к явлению массивной клеточной гибели (некроз), разрастанию соединительной ткани в органе (фиброз), развитию новообразований в отдаленные периоды после действия токсиканта, тератогенезу (рис. 16).
мутагенез;
канцерогенез
фотосенсибилизация,
фотоаллергия
гемолиз
эритроцитов
некроз
клеток
фиброз
пораженных органов
Рис.
16.
Активация свободнорадикальных процессов
в клетках и их последствия
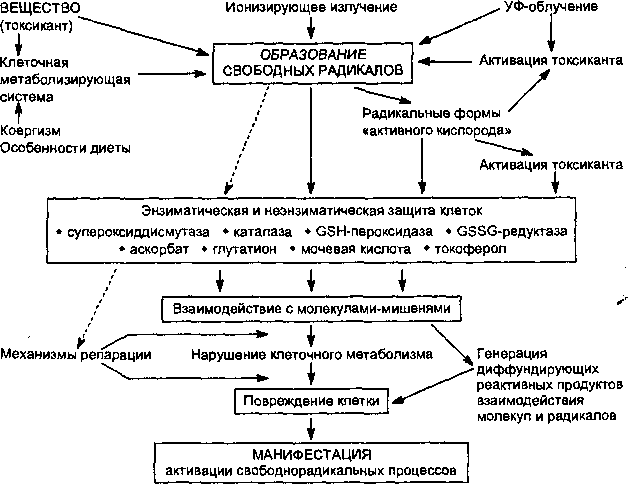
Характер повреждающего действия активных радикалов во многом определяется их стабильностью и расстоянием, на которое они могут мигрировать от места своего образования. Наиболее реакционноспособные радикалы (винилгалогены, дигидропиридины) разрушают только образующие их энзимы. Метаболиты, обладающие меньшей реакционной способностью, способны выходить даже за пределы органов, в которых они образуются, и повреждать другие органы и ткани (метаболиты гексана вызывают периферическую нейропатию; метаболиты пирроли- зидиновых алкалоидов мигрируют из печени в легкие, где повреждают сосуды и т. д.).
Повреждение мембранных структур
Помимо непосредственного действия на липидный бислой (см. выше) возможны и иные механизмы повреждения токсикантами биомембран. К числу важнейших относятся:
активация перекисного окисления липидов;
активация фосфолипаз.
Активация перекисного окисления липидов. Благодаря высокому содержанию ненасыщенных связей в углеводородной цепи жирных кислот, фосфолипиды клеточных мембран наиболее предрасположены к реакции окисления, инициируемой свободными радикалами, образующимися в клетке (см. выше). Этому способствует то обстоятельство, что молекулярный кислород в 7—8 раз лучше растворяется в липидной фазе, чем в воде и гидрофильных сайтах клетки. Атака активных форм кислорода на ненасыщенные связи жирных кислот приводит к образованию пероксидных радикалов («перекисное окисление липидов») и разрушению биологических мембран. Процесс перекисного окисления сопровождается также образованием из липидов высокореакционноспособных и легко диффундирующих карбонильных радикалов, которые могут обусловливать неблагоприятные процессы, развивающиеся в клетках далеко за пределами места своего образования — не только клетки, но и органа. Хорошо кро- воснабжающиеся и насыщенные кислородом ткани (легкие, сердце, головной мозг) являются более чувствительными к повреждающему действию прооксидантов.
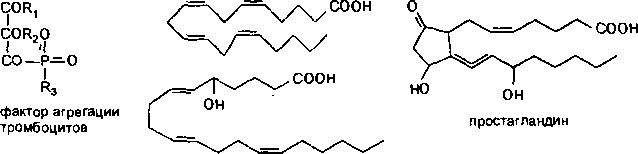
Активация фосфолипаз. Важным механизмом повреждения биологических мембран является гидролиз фосфолипидов, наступающий вследствие активации фосфолипаз (особенно фосфолипазы А2). Активация энзима происходит в результате прямого или опосредованного (гипоксия, нарушение гомеостаза внутриклеточного кальция и т. д.) действия многих токсикантов на клетки организма (рис. 17).
В результате действия фосфолипазы А2 на липиды биологических мембран высвобождается арахидоновая кислота. Последняя является, в свою очередь, субстратом энзима циклооксигеназы. Превращение арахи- доновой кислоты под влиянием энзима приводит к образованию эйкоза- ноидов (простагландинов, тромбоксанов, простациклинов) — веществ,
активирующих воспалительные процессы в тканях. Под влиянием другого энзима 5-липоксигеназы арахидоновая кислота превращается в лейкотриены и эйкозатетраеноевые кислоты — химиоатрактанты нейтрофи- лов, вещества, регулирующие сосудистую проницаемость.
Еще одним продуктом энзиматического расщепления липидов мембран является фактор агрегации тромбоцитов (ФАТ) — клон биологически активных веществ (более 150 аналогов) близкого строения. ФАТ — чрезвычайно токсичные вещества (LD50 для кролика — 0,005 мг/кг; для собаки — 0,07 мг/кг), вызывающие при внутривенном введении шокоподобное состояние (острый, некупируемый коллапс, бронхоспазм и др.).

лейкотриены
Рис.
17.
Образование биологически активных
веществ при участии фосфолипаз,
активируемых в ходе токсического
процесса
Поскольку система внутриклеточных мембран также является мишенью для действия многочисленных токсикантов, среди них можно выделить группу митохондриальных ядов, повреждающих различные звенья процессов биоэнергетики, — веществ, действующих на шероховатый (нарушение процессов синтеза белка) и гладкий эндоплазматический рети- кулум (индукция или угнетение метаболизма ксенобиотиков), лизосома- льные мембраны (провоцируют аутолиз клеток) и др.
