
- •Составители:
- •Т.Б.Мошкова, доц., канд. С.-х. Наук
- •Общие методические указания
- •Обязательный минимум содержания дисциплины
- •Специальные вопросы химии
- •Контрольное задание 1
- •Моль. Эквиваленты и молярные массы
- •Эквивалентов простых и сложных веществ
- •Закон эквивалентов
- •Строение атома
- •Периодическая система элементов д.И.Менделеева
- •Химическая связь и строение молекул
- •Элементы химической термодинамики Энергетика химических процессов
- •Кинетика химических процессов Химическое равновесие
- •Способы выражения концентрации растворов
- •Общие свойства растворов
- •Электролитическая диссоциация Реакции в растворах электролитов
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз расплавов и растворов
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения Полимеры
- •Химические элементы Их соединения и аналитические реакции
- •Теоретические основы аналитической химии
- •Задания
- •Качественный анализ
- •Количественный анализ
- •Задания
- •Органические соединения
Электролиз расплавов и растворов
Электролизом называют процессы, протекающие под действием электрического тока на электродах, погруженных в расплав или раствор электролита. При электролизе происходит превращение электрической энергии в химическую.
При электролизе расплава соли или щелочи на катоде всегда восстанавливаются катионы металла, а на аноде окисляются анионы кислотного остатка (электролиз расплавов солей) или гидроксид – анионы (электролиз расплавов щелочей).
Пример 1.Составьте электронные уравнения процессов, происходящих на электродах при электролизе расплава щелочи гидроксида натрия.
Решение.При плавлении происходит термическая диссоциация щелочи:
NaOHNa++OH
Под действием электрического тока происходит направленное движение ионов. На катоде будет идти восстановление катионов Na+, на аноде – окисление гидроксид –анионов:
(-) Катод Na+OHАнод (+)
Na+ + 1eNa4ОН- 4е2Н2О + О2
 Суммарное
уравнение:
Суммарное
уравнение:
Na+ + 1ēNa4
4ОН- 4ē2Н2О + О21
 4Na++ 4OH4Na+ 2H2O+O2
4Na++ 4OH4Na+ 2H2O+O2
Молекулярное уравнение:
4NaOH
![]() 4Na+O2+ 2H2O
4Na+O2+ 2H2O
В водных растворах электролитов находятся гидратированные ионы растворенного вещества и молекулы воды. При электролизе растворов наряду с процессами восстановления катионов и окисления анионов вещества на электродах, могут восстанавливаться или окисляться и молекулы воды.
На катодепротекает процесс восстановления. В зависимости от величин стандартных электродных потенциалов металлов (табл. 6) возможны три варианта катодного процесса при электролизе.
1.Если соль образована катионами металлов, расположенными в раду стандартных электродных потенциалов от Li+доAl3+включительно, то на катоде происходит электрохимическое восстановление молекул воды с выделением водорода:
2Н2О + 2ēН2+ 2ОН
2.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после водорода, на катоде восстанавливаются катионы этих металлов:
Меn++nēМе
3.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после Al3+до водорода, то на катоде восстанавливаются катионы металлов одновременно с молекулами воды:
Меn++nēМе
2Н2О + 2ēН2+ 2ОН
На анодепротекает процесс окисления. Характер реакций, протекающих на аноде, зависит от природы электролита, присутствия молекул воды и материала анода. Аноды подразделяются на нерастворимые и растворимые.
В случае нерастворимых (инертных) анодов возможны два варианта анодного процесса при электролизе.
1.Если соль образована бескислородной кислотой (кроме фторидов), то на аноде окисляются анионы этих кислот, например:
2J- 2ēJ2
или S2- 2ēS
2.Если соль образована кислородсодержащей кислотой, то на аноде окисляются молекулы воды с выделением О2:
2Н2О – 4ēО2+ 4Н+
Если электролизу подвергается раствор щелочи, то на аноде будут окисляться гидроксид – ионы:
4ОН- 4ēО2+ 2Н2О
В случае растворимых (активных) анодовсам анод подвергается окислению:
Ме Меn++nē
металл уходят уходят
анода в раствор во внешнюю цепь
Образующиеся катионы переходят в раствор, анод при этом растворяется.
Пример 2.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора хлорида натрияNaClс нерастворимым анодом.
Решение.Натрий располагается в начале ряда стандартных электродных потенциалов до алюминия и на катоде будут восстанавливаться молекулы воды. На аноде будут окисляться хлорид – ионы, так как это анионы бескислородной кислоты:
NaClNa++Cl
(-) Катод Na+ClАнод (+)
Н2О
2Н2О + 2ēН2+ 2ОН2Cl-2ēCl2
Суммарное уравнение:
2Н2О + 2ēН2+ 2ОН
 2Cl-2ēCl2
2Cl-2ēCl2
2Н2О + 2ClН2+ 2ОН+Cl2
В прикатодном пространстве накапливаются катионы Na+и анионы ОН, образуя щелочьNaOH.
Молекулярное уравнение:
2NaCl+ 2H2O
![]() H2+Cl2+ 2NaOH
H2+Cl2+ 2NaOH
катод анод в прикатодном
пространстве
Пример 3.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствораAg2SO4. Сколько граммов серебра выделится на катоде при электролизе раствора Ag2SO4в течение 60 минут при силе тока 4А? Чему равен объем газа, выделившегося на аноде?
Решение.Серебро располагается в ряду стандартных электродных потенциалов после водорода, следовательно, на катоде будет идти восстановление катионов серебра. На аноде идет окисление молекул воды с выделением кислорода, т.к. соль образована кислородосодержащей кислотой.
Ag2SO4 2 Ag+ + SO42-
(-) Катод 2 Ag+ SO42- Анод (+)
Н2О
2Ag++ 2ē2Ag2H2O- 4ēO2+ 4H+
В прианодном пространстве накапливаются ионы SO42-и Н+, образуя кислоту Н2SO4.
Суммарное уравнение:
 2Ag++ 2ē = 2Ag2
2Ag++ 2ē = 2Ag2
2H2O - 4ē = O2 + 4H+ 1
 4Ag+
+ 2H2O
= 4Ag + O2
+ 4H+
4Ag+
+ 2H2O
= 4Ag + O2
+ 4H+
или
2Ag2SO4+ 2Н2О
![]() 4Ag
+ О2+ 2Н2SO4
4Ag
+ О2+ 2Н2SO4
катод анод в прианодном
пространстве
По законам Фарадея масса выделившихся на электродах веществ (m) определяется по формуле:
![]() ,
,
где Мэ– молярная масса эквивалента вещества, г/моль;
J – сила тока, А;
- продолжительность электролиза, с;
F – число Фарадея (96500 Кл).
Молярная масса эквивалента серебра в Ag2SO4равна отношению молярной массы серебра к его валентности:
Мэ(Ag)= МAg/1 = 107,87 г/моль.
Подставив в формулу значения Мэ(Ag)= 107,87 г/моль,J= 4А,
= 60 60 = 3600 с, получим:
![]() .
.
При определении объемов выделившихся газов закон Фарадея имеет вид:
![]() ,
,
где V– объем выделившегося газа, л;
Vэ– молярный объем эквивалента газа, л.
Молярная
масса кислорода М![]() = 32 г/моль, молярная масса эквивалента
кислорода М
= 32 г/моль, молярная масса эквивалента
кислорода М![]() = 8 г/моль. Молярный объем эквивалента
кислорода рассчитываем, исходя из
следствия закона Авогадро:
= 8 г/моль. Молярный объем эквивалента
кислорода рассчитываем, исходя из
следствия закона Авогадро:
32 г кислорода при н.у. занимают объем 22,4 л
8 г кислорода при н.у. занимают объем х л (Vэ)
![]() ,
тогда объем кислорода, выделившегося
на аноде, будет равен:
,
тогда объем кислорода, выделившегося
на аноде, будет равен:
![]() .
.
Пример 4.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствораNi(NO3)2. Вычислите продолжительность электролиза, если при силе тока 3А на катоде выделилось 5,8 г никеля.
Решение.Никель располагается в ряду стандартных электродных потенциалов после алюминия, но до водорода. На катоде будет происходить восстановление катионов никеля, а также молекул воды с выделением водорода. На аноде идет окисление молекул воды с выделением кислорода.
Ni(NO3)2Ni2++ 2NO3
(-) Катод Ni2+ 2NO3 Анод (+)
Н2О
Ni2++ 2ēNi0
2Н2О + 2ēН20+ 2ОН 2Н2О - 4ēО2+ 4Н+
В прианодном пространстве накапливаются ионы NO3- и Н+, образуя кислоту НNO3.
Суммарное уравнение
Ni2++ 2ēNi0


 2Н2О + 2ēН20+ 2ОН
2Н2О + 2ēН20+ 2ОН
2Н2О - 4ēО2+ 4Н+ 2Н2О + 2Н+


Ni2++2Н2О =Ni+ Н2+ О2+ 2Н+
или
Ni(NO3)2
+ 2Н2О![]() Ni+ Н2+ О2+
2НNO3
Ni+ Н2+ О2+
2НNO3
катод анод в прианодном
пространстве
Для вычисления времени электролиза используем математическое выражение законов Фарадея:
![]() .
.
Молярная масса эквивалента никеля в Ni(NO3)2равна отношению молярной массы никеля к его валентности: Мэ(Ni)= 58,71/2 = 29,35 г/моль.
Продолжительность электролиза:
![]()
Пример 5. На сколько граммов уменьшится масса висмутового анода, если электролиз раствораBiCl3проходит при силе тока 2А в течение
40 минут? Составьте схему электролиза.
Решение.Процесс электролиза срастворимым анодомсводится к окислению атомов материала анода и восстановлению на катоде катионов висмута из раствора, т.е. к переносу висмута с анода на катод. Анод растворяется, при этом количество ионов висмутаBi3+в растворе остается неизменным.
BiCl3Bi3++ 3Cl-
(-) Катод Bi3+3Cl-Анод (+)
висмутовый

 Bi3++ 3ēBi0Bi0- 3ēBi3+
Bi3++ 3ēBi0Bi0- 3ēBi3+

Процесс будет продолжаться до полного растворения анода.
По законам Фарадея рассчитаем массу выделившегося на катоде висмута:
![]() ,
гдеJ= 2А,= 4060 = 2400 с.
,
гдеJ= 2А,= 4060 = 2400 с.
Молярная масса эквивалента висмута в BiCl3равна отношению молярной массы висмута к его валентности:
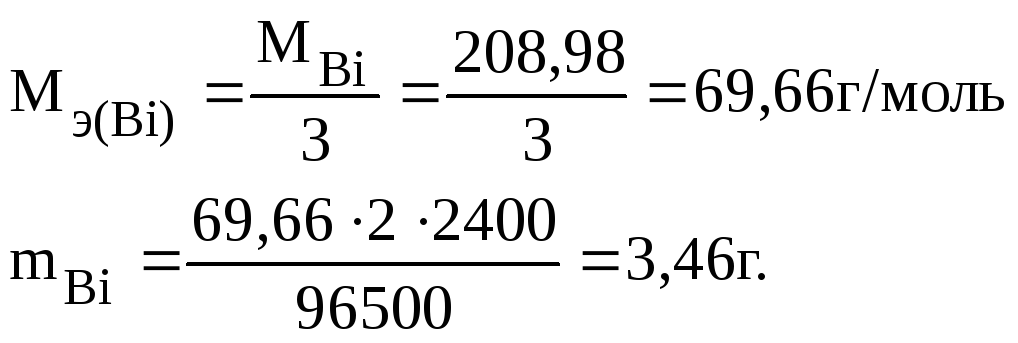
Следовательно, масса висмутового анода уменьшилась на 3,46 г.
ЗАДАНИЯ
261.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН и расплава КОН. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора КОН в течение 1ч при силе тока 6А.
262.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CuSO4и КJ. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствораCuSO4в течение 30 мин при силе тока 4А.
263.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов Na2SO4 иHgCl2. Сколько граммов воды разлагается при электролизе раствораNa2SO4при силе тока 7А в течение 5 ч?
264.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов К2SO4иCuCl2. Вычислите объем выделившихся на электродах веществ, если электролиз К2SO4проводили при силе тока 5А в течение 3ч.
265.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgCl2и NiSO4. Вычислите продолжительность электролиза раствора NiSO4в минутах, если при силе тока 8А на катоде выделилось 1,8г никеля.
266.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора CuCl2: а) если анод медный; б) если анод инертный. Вычислите количество выделившейся меди на катоде, если электролизCuCl2с инертным анодом проводили в течение 5 часов при силе тока 5А.
267.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CuSO4и КCl. Вычислите, сколько граммов меди выделилось на катоде, если при электролизе раствораCuSO4на аноде выделилось 168 мл кислорода, измеренного при н.у.
268.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов Zn(NO3)2и NaBr. Вычислите силу тока, если электролиз раствора нитрата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н.у.
269.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора ZnSO4: а) в случае инертного анода; б) в случае цинкового анода. Вычислите, на сколько граммов уменьшится масса цинкового анода, если электролиз раствораZnSO4 происходит при силе тока 2А в течение 40 мин.
270.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов NaJ и CdSO4. Вычислите, какие вещества и в каком количестве выделятся при электролизе раствора NaJ в течение 2,5 ч, если сила тока равна 6А.
271.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора NiCl2, если анод сделан из никеля, и раствора AgNO3, если анод инертный. Как изменится масса никелевого анода после пропускания тока силой 3,2А в течение 30 мин?
272.Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе расплава NaClи водного раствораNaCl. Сколько литров (н.у.) газа выделится на аноде при электролизе раствора хлорида натрия, если электролиз проводить в течение 30 мин при силе тока 0,5А?
273.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4иZnCl2. Вычислите силу тока при электролизе раствора MgSO4в течение 1 ч 40 мин, если на катоде выделилось 1,4 л водорода (н.у.).
274.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым - серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствораAgNO3с нерастворимым анодом, если время электролиза 50 мин, сила тока 2А.
275.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов CdCl2иNa2CO3. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора карбоната натрия в течение 180 мин при силе тока 5А.
276.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов KNO3и CuBr2. Электролиз раствораKNO3проводили в течение 5 ч при силе тока 7А. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде.
277.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов KBr и Hg(NO3)2. Какие вещества и в каком количестве выделяются на инертных электродах при электролизе водного раствора KBr в течение 1 ч 35 мин при силе тока 15 А?
278.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KCl и расплава KCl. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора KCl в течение 60 мин при силе тока 5 А.
279.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов AgNO3и FeCl2. Электролиз раствораAgNO3проводили при силе тока 2 А в течение 4 часов. Сколько граммов серебра выделилось на катоде?
280.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора FeSO4, с нерастворимым анодом и с растворимым – железным анодом. Вычислите продолжительность (в мин) электролиза раствораFeSO4с нерастворимым анодом при силе тока 10А, если на катоде выделилось 6,8 г железа.
