
- •Составители:
- •Т.Б.Мошкова, доц., канд. С.-х. Наук
- •Общие методические указания
- •Обязательный минимум содержания дисциплины
- •Специальные вопросы химии
- •Контрольное задание 1
- •Моль. Эквиваленты и молярные массы
- •Эквивалентов простых и сложных веществ
- •Закон эквивалентов
- •Строение атома
- •Периодическая система элементов д.И.Менделеева
- •Химическая связь и строение молекул
- •Элементы химической термодинамики Энергетика химических процессов
- •Кинетика химических процессов Химическое равновесие
- •Способы выражения концентрации растворов
- •Общие свойства растворов
- •Электролитическая диссоциация Реакции в растворах электролитов
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз расплавов и растворов
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения Полимеры
- •Химические элементы Их соединения и аналитические реакции
- •Теоретические основы аналитической химии
- •Задания
- •Качественный анализ
- •Количественный анализ
- •Задания
- •Органические соединения
Общие свойства растворов
К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания, повышение температуры кипения и осмотическое давление.
Исследование свойств разбавленных растворов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля.
В общем виде зависимость повышения температуры кипения tкип.и понижения температуры замерзанияtзам.разбавленных растворов от концентрации можно записать так:
tкип= КэСmиtзам= КкСm,
где Кэи Кк– эбулиоскопическая и криоскопическая постоянные растворителя (Скгмоль1 или Ккгмоль1).
Сm– моляльность вещества в растворе (моль/кг)
В этих уравнениях моляльную концентрацию
можно заменить отношением массы
растворенного вещества в 1000 г растворителя
(m) к молярной массе этого
вещества (М). Тогда![]()
По этой формуле можно рассчитать молярную массу растворенного вещества.
Пример 1.Вычислите температуры кристаллизации и кипения водного раствора глюкозы с массовой долей С6Н12О62 %.
Решение.По закону Рауля:![]() или
или![]() (1)
(1)
и
![]() или
или![]() (2)
(2)
Для воды Кк= 1,86 и Кэ= 0,52
Молярная
масса глюкозы
![]()
Исходя из понятия массовой доли растворенного вещества, выраженной в процентах: в 100 г раствора содержится 2 г глюкозы. Следовательно, масса растворителя будет равна: 100-2=98 г.
Найдем массу растворенного вещества в 1000 г растворителя (воды):
в 98 г воды содержится 2 г глюкозы
в 1000 г воды содержится mг глюкозы
![]()
Следовательно,
понижение температуры замерзания
раствора по формуле (1):![]()
Так как
![]() ,
то температура замерзания (кристаллизации)
раствора равна:
,
то температура замерзания (кристаллизации)
раствора равна:
![]() ,
где 0С -
температура замерзания воды.
,
где 0С -
температура замерзания воды.
Повышение
температуры кипения раствора равно по
формуле (2):
![]()
Вода
кипит при 100 С,
следовательно, температура кипения
этого раствора равна:![]()
Пример 2.Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,5290С. Температура кипения сероуглерода 46,30С. Вычислите эбулиоскопическую константу сероуглерода.
Решение.По закону Рауля:![]() (2) ,
(2) ,
где tкип– повышение температуры кипения раствора равно:
![]()
Молярная масса
бензойной кислоты
![]()
Найдем массу растворенного вещества в 1000 г растворителя:
в 100 г сероуглерода содержится 1,22 г бензойной кислоты
в 1000 г сероуглерода содержится mг бензойной кислоты
![]()
Из формулы (2) находим эбулиоскопическую константу:
![]()
Пример
3.Раствор, содержащий 11,04 г глицерина
в 800 г воды, кристаллизуется приt![]() = –0,2790С. Вычислите молярную массу
глицерина.
= –0,2790С. Вычислите молярную массу
глицерина.
Решение.Из формулы (1) находим молярную массу: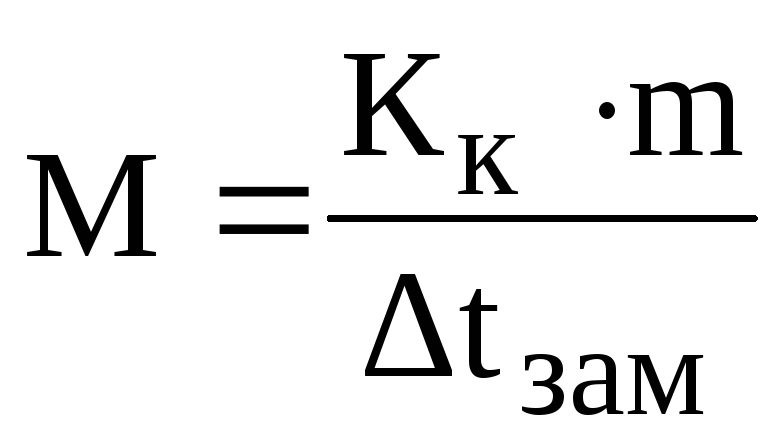
Температура кристаллизации чистой воды 0 С, следовательно, понижение температуры кристаллизации (замерзания) равно:
t![]() = 0 – (-0,279) = 0,279С
= 0 – (-0,279) = 0,279С
Криоскопическая константа для воды Кк= 1,86. Массу глицерина (m), приходящуюся на 1000 г воды найдем из пропорции:
в 800 г Н2О содержится 11,04 г глицерина
в 1000 г Н2О содержитсяmг глицерина
![]()
Подставляя
в уравнение числовые значения Кк,mиt![]() ,
находим молярную массу глицерина:
,
находим молярную массу глицерина:

Пример 4.Вычислите массовую долю (в процентах) мочевины (NH2)2COв водном растворе, зная, что раствор замерзает при температуре
tзам. раствора= –0,4650С.
Решение.Температура замерзания чистой воды 00С, следовательно,
t![]() =
0 – (-0,465) = 0,465С. Зная,
что молярная масса мочевины
=
0 – (-0,465) = 0,465С. Зная,
что молярная масса мочевины![]() ,
находим массуm(г)
растворенного вещества в 1000 г воды, из
формулы (1):
,
находим массуm(г)
растворенного вещества в 1000 г воды, из
формулы (1):
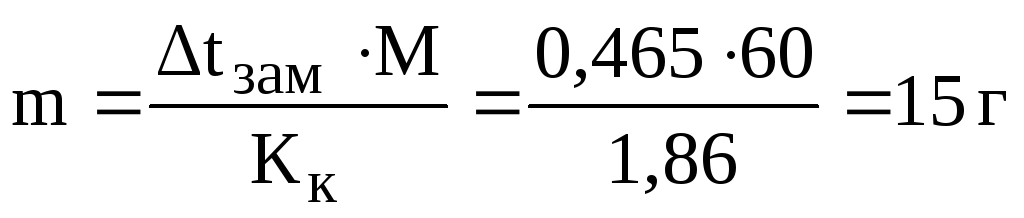
Общая масса раствора равна сумме масс растворенного вещества и растворителя: mраствора= 1000 + 15 = 1015 г.
Массовую долю мочевины в данном растворе находим из соотношения:
в 1015 г раствора содержится 15 г мочевины
в 100 г раствора содержится х г мочевины
![]()
Массовая доля мочевины в водном растворе составляет 1,48 %.
ЗАДАНИЯ
161. Раствор, содержащий 0,512 г вещества в 100 г бензола, кристаллизуется при 5,296 0С. Температура кристаллизации бензола 5,50С. Криоскопическая константа 5,1. Вычислите молярную массу растворенного вещества.
162. Вычислите массовую долю (в процентах) сахара С12Н22О11в водном растворе, зная температуру кристаллизации этого раствора
t![]() = -0,930С. Криоскопическая
константа воды 1,86.
= -0,930С. Криоскопическая
константа воды 1,86.
163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды равна 1,86.
164. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,7140С. Температура кипения бензола 80,20С. Вычислите эбулиоскопическую константу бензола.
165.Вычислите массовую долю (в процентах) глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,390С. Эбулиоскопическая константа воды 0,52.
166. Вычислите молярную массу вещества, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при
t![]() =
– 0,2790С. Криоскопическая константа
воды 1,86.
=
– 0,2790С. Криоскопическая константа
воды 1,86.
167. Вычислите температуру кипения раствора нафталина С10Н8 в бензоле с массовой долей С10Н85 %. Температура кипения бензола 80,2С. Эбулиоскопическая константа бензола равна 2,57.
168.
Раствор, содержащий 25,65 г некоторого
вещества в 300 г воды, кристаллизуется
при t![]() = – 0,4650С. Вычислите молярную массу
растворенного вещества. Криоскопическая
константа воды 1,86.
= – 0,4650С. Вычислите молярную массу
растворенного вещества. Криоскопическая
константа воды 1,86.
169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14Н10в 100 г уксусной кислоты, кристаллизуется при 15,7180С. Температура кристаллизации уксусной кислоты 16,650С.
170. Равные массовые количества камфоры С10Н16О и нафталина С10Н8растворены в одинаковых количествах бензола. Какой из этих растворов кипит при более высокой температуре?
171.
Температура кристаллизации раствора,
содержащего 66,3 г некоторого вещества
в 500 г воды, равна t![]() =
–0,5580С. Вычислите молярную массу
растворенного вещества. Криоскопическая
константа воды 1,86.
=
–0,5580С. Вычислите молярную массу
растворенного вещества. Криоскопическая
константа воды 1,86.
172. Сколько граммов анилина С6Н5NH2следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,530С. Эбулиоскопическая константа этилового эфира 2,12.
173. Вычислите температуру кристаллизации водного раствора этилового спирта с массовой долей С2Н5ОН 2 %. Криоскопическая константа воды 1,86.
174. Сколько граммов мочевины (NH2)2COследует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650С? Криоскопическая константа воды 1,86.
175. Вычислите массовую долю (в процентах) глюкозы С6Н12О6в водном растворе, зная, что этот раствор кипит при 100,260С. Эбулиоскопическая константа воды 0,52.
176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,70С? Криоскопическая константа бензола 5,1.
177.Сколько граммов мочевины (NH2)2COследует растворить в 250 г воды, чтобы температура кипения повысилась на 0,260С? Эбулиоскопическая константа воды 0,52.
178. При растворении 2,3 г некоторого вещества в 125 г воды температура кристаллизации понижается на 0,372 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
179. Вычислите температуру кипения водного раствора пропилового спирта с массовой долей С3Н7ОН 15 %. Эбулиоскопическая константа воды 0,52.
180. Вычислите массовую долю (в процентах) метанола СН3ОН в водном растворе, температура кристаллизации которогоtзам= –2,790С. Криоскопическая константа воды 1,86.
