
40_Схемы электронных возбуждённых состояний
.docОтветы к госам(38, 40, 44)
40. Схемы электронных возбуждённых состояний, синглетное и триплетное возбуждённые состояния, их особенности и значение в биосистемах
Возбуждение в квантовой физике происходит как квантовый скачок квантовой системы (атома, молекулы, атомного ядра) с любого энергетического уровня на более высокий. Возбуждение системы происходит за счет поглощения системой энергии — например, при поглощении фотонов (фотовозбуждение) или при столкновениях с электронами и др. частицами (возбуждение ударом).
Возбужденные состояния атомов. Образуются из основного состояния при переходе одного или нескольких электронов (напр., под действием излучения) с занятых орбиталей на свободные (или занятые лишь одним электроном). Возбужденные состояния молекул. Электронные возбужденные состояния отличаются от остальных тем, что характеризуют совершенно иное электронное строение молекул и их химические свойства. Эти возбужденные состояния определяют протекание фотохимических, а также некоторых радиационно-химических и плазмохимических реакций. Дискретность энергетических уровней в атомах обусловлена квантово-механическим характером движения злектронов. В молекулах также имеются определенные энергетические уровни злектронов. Однако кроме движения электронов в молекулах возможно еще перемещение атомных ядер друг относительно друга - колебание ядер и вращение их вокруг центра масс. ЛИНЕЙЧАТЫЕ СПЕКТРЫ - оптические спектры испускания и поглощения, состоящие из отдельных спектральных линий. При определении энергии молекулы учитываются: движение электронов в молекуле, колебания атомов в молекуле, вращение молекулы, поступательное движение центра масс молекулы.
Сигма, пи и эн орбитали. Образование простых связей с помощью сигма-электронов. Образование сопряжённых двойных связей с помощью пи-электронов. Эн-электроны – это неподелённые пары электронов гетероатомов, входящих в состав молекулы.
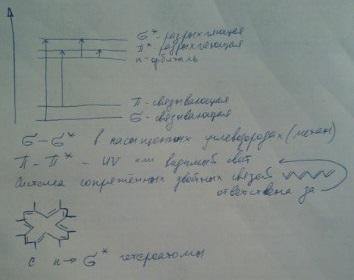
Наибольшей энергии требуют переходы сигма-сигма. Такие переходы характерны для молекул насыщенных углеводородов и соответствуют поглощению в области длин волн меньше 200нм. Переходы пи-пи происходят в молекулах ненасыщенных соединений и соответствуют поглощению в видимой или ближней УФ области.
Выражения, описывающие энергию молекулы.
Полная (общая) энергия молекулы равна: Еобщ = Еэл + Екол + Евращ. Еэл – энергия электронных уровней, Екол – энергия колебательных подуровней, Евращ – энергия вращательных подуровней.
Электронные переходы в биомолекулах.

Основное невозбуждённое состояние: электроны находятся попарно на орбите и спины электронов антипараллельны (синглетное невозбуждённое состояния S0). Невозбуждённое состояние. Электрон находится на неком колебательном подуровне S0. Поглатив квант света электрон переходит на некий подуровень S*. Время жизни на S* 10-12c. Потом электрон самопроизвольно переходит на основное S*. Разница энергий переходит в тепло.
Пути:
1) переход электрона из S1 в S0 без излучения. При этом энергия рассеивается.
2) переход электрона на некий колебат. подуровень S0. Энергия высвечивается в виде кванта света – флуоресценция.
3) переход в триплетное состояние. Интерконвекционное рассеивание.
4) Энергия излучательных состояний может мигрировать. Передаваться другой молекуле безизлучательно.
5) Энергия может расходоваться на фотохимические превращения.
Время жизни в триплетном состоянии 10-4с. Дольше, чтобы изменить спин.
Флуоресце́нция
(вариант: флюоресценция) —
физический процесс, разновидность
люминесценции.
Флуоресценцией обычно называют
излучательный переход возбужденного
состояния с самого нижнего синглетного
колебательного уровня S1
в основное состояние S0.
В общем случае флуоресценцией называют
разрешенный
по спину
излучательный переход между двумя
состояниями одинаковой мультиплетности:
между синглетными
уровнями
![]() или
триплетными
или
триплетными
![]() .
.
Правило Стокса. Спектр флуоресценции и его максимум всегда сдвинуты относительно спектра поглощения и его максимума в сторону длинных волн. Это означает, что вещества, поглощающие ультрафиолетовый свет, могут флуоресцировать любым светом, но вещества, флуоресценция которых возбуждается, например, синим светом, не могут светиться лиловым, а только зеленым, желтым, красным, словом, расположенным в более длинноволновой части спектра.

Тепловая диссипация - переход части энергии упорядоченного процесса в физической системе в энергию неупорядоченного процесса, а в конечном счете в тепловую энергию.
Внутренняя конверсия - физическое явление, заключающееся в том, что переход атомного ядра из возбуждённого изомерного состояния в состояние с меньшей энергией (или основное состояние) осуществляется путём передачи высвобождаемой при переходе энергии непосредственно одному из электронов этого атома. Таким образом, в результате этого явления испускается не γ-квант, а так называемый конверсионный электрон, энергия которого определяется разностью между энергией ядерного изомерного перехода и энергией связи определенной оболочки, с которой электрон был испущен. Кроме того, небольшая доля энергии (сотые или тысячные доли процента) передаётся самому атому в результате эффекта отдачи.
Интеркомбинационная конверсия — процесс безызлучательного перехода между состояниями различной мультиплетности. При этом не происходит изменения полной энергии молекулы. Константа скорости этого процесса должна составлять время порядка 1012 с−1, но из-за запрета по спину ее величина значительно падает и оказывается в пределах от 1011 до 107 с−1.
