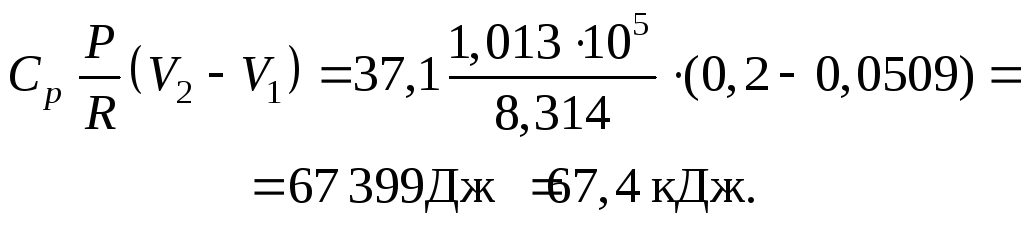- •Министерство образования и науки российской федерации
- •Гоу впо череповецкий государственный университет
- •Методические указания к практическим занятиям по курсу «физическая химия»
- •Учебно-методическое пособие
- •Введение
- •1. Первый закон термодинамики
- •1.1. Термодинамические процессы
- •1.2. Теплоемкость. Зависимость теплоемкости от температуры.
- •1.3. Закон Гесса
- •1.4. Зависимость теплового эффекта химической реакции от температуры:
- •2. Второй закон термодинамики
- •2.1 Вычисление изменения энтропии в различных процессах
- •2.2. Вычисление изменения изобарного и изохорного потенциалов в различных процессах
- •3. Химическое равновесие
- •3.1. Расчет равновесий по экспериментальным данным
- •3.2. Расчеты по уравнениям изотермы, изобары и изохоры химической реакции
- •Основной
- •162600, Г. Череповец, пр. Луначарского, 5
1.4. Зависимость теплового эффекта химической реакции от температуры:
Зависимость теплового эффекта от температуры определяется уравнением Кирхгофа, дифференциальная форма:
![]() и
и
![]()
Здесь:
![]()
В интегральной форме уравнение Кирхгофа имеет вид:
![]()
При
Т1=
298К и Т2=Т:
![]()
Учитывая зависимость теплоемкости от температуры:
![]() и
и
![]()
где:
![]() и т.д.
и т.д.
Подставляем значение ∆Ср в уравнение Кирхгофа и интегрируем:
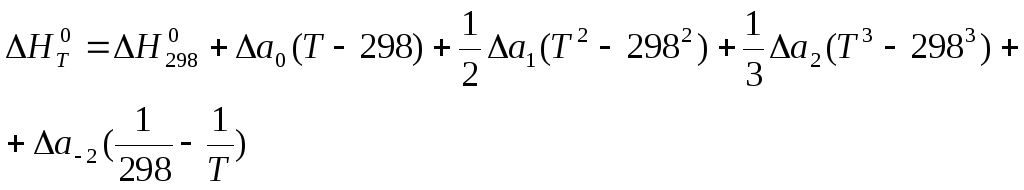
здесь:
![]()
Полученное уравнение дает возможность вычислять тепловые эффекты реакций при любых температурах, если известны теплоты образования и зависимости теплоемкостей от температуры всех участников реакции.
Пример 5:
Вычислить тепловой эффект химической реакции:
2Н2+СО=СН3ОНг при 500К и постоянном давлении, если стандартные теплоты образования равны:
![]()
![]() ,
а зависимости мольных теплоемкостей
реагентов (Дж/моль*К) от температуры
выражаются уравнениями:
,
а зависимости мольных теплоемкостей
реагентов (Дж/моль*К) от температуры
выражаются уравнениями:
![]()
![]()
![]()
Решение:
Определяем ∆СР :
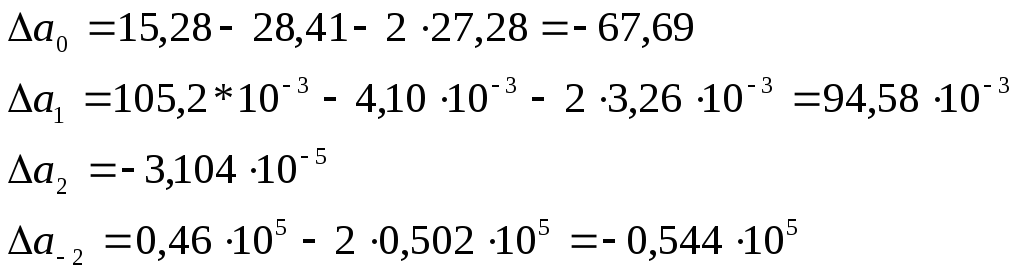
Отсюда:
![]()
Определяем:
![]() :
:
![]()
Определяем
![]() :
:
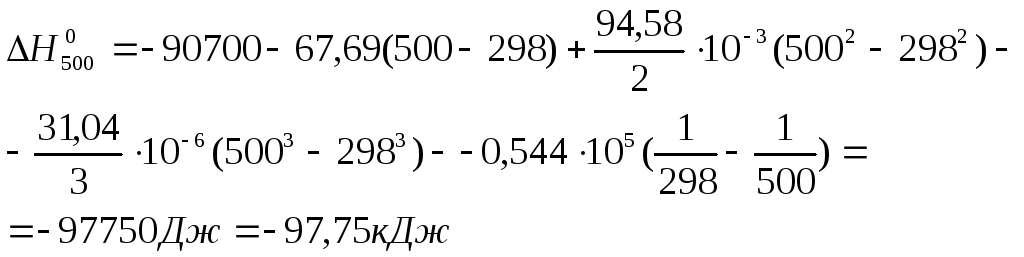
2. Второй закон термодинамики
2.1 Вычисление изменения энтропии в различных процессах
Математическое выражение второго закона термодинамики записывается:
![]()
Здесь знак > относится к необратимым процессам, а знак = к обратимым. Так как энтропия является функцией состояния, ее изменение при протекании как обратимого, так и необратимого процессов одинаково. Поэтому при расчете изменения энтропии необходимо пользоваться формулами для обратимых процессов.
Энтропия обладает свойствами аддитивности, поэтому изменение энтропии в сложном процессе равно сумме изменений энтропий в отдельных его стадиях. Абсолютное значение энтропии какого-либо вещества при любой температуре можно рассчитать, если известна абсолютная энтропия при какой-то одной температуре, например, при 298К и температурные коэффициенты теплоемкости:
 ,
,
![]()
Изменение энтропии в различных процессах вычисляют по следующим уравнениям:
При нагревании n – моль вещества от Т1 до Т2 при P = const:
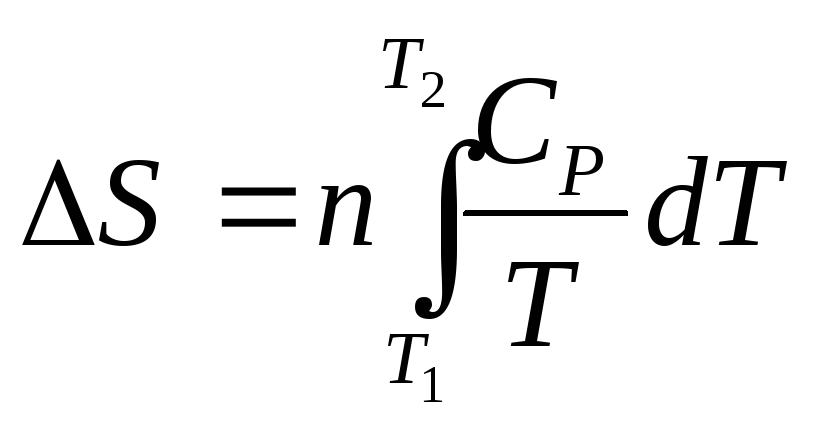 где
где
![]()
Интегрирование дает:
![]()
При фазовом превращении:
![]() где
λ – молярная теплота фазового перехода
(плавления, испарения, сублимации,
модификационного превращения); Т –
температура фазового перехода.
где
λ – молярная теплота фазового перехода
(плавления, испарения, сублимации,
модификационного превращения); Т –
температура фазового перехода.
При переходе n – моль идеального газа из состояния 1 в состояние 2 при Т=const:
при
![]() при
при![]()
При смешении идеальных газов (Т,Р=const):
![]() ,
где n1
и n2
– числа моль первого и второго газа: V1
и V2
– их начальные объемы:
,
где n1
и n2
– числа моль первого и второго газа: V1
и V2
– их начальные объемы:
V= V1 + V2 - конечный объем.
Пример 6:
Определить изменение энтропии при превращении 2г льда, взятого при температуре 253К и давлении 1,013*105 н/м2 в пар при температуре 423К, если теплота плавления льда при 273К равна 0,335 кДж/г, удельная теплоемкость льда равна 2,02 Дж/г*К воды – 4,2 Дж/г.К, скрытая теплота парообразования воды равна 2,255 кДж/г, мольная теплоемкость пара при постоянном давлении:
Ср = 30,13+11,3*10-3Т, Дж/моль.К
Решение:
Данный процесс состоит из пяти стадий:
1) нагревание льда от 253 до 273 К – ∆S1;
2) плавление льда при 273 К – ∆S2;
3) нагревание жидкой воды от 273 до 373 К – ∆S3;
4) переход жидкой воды в пар при 373К – ∆S4;
5) нагревание водяного пара от 373 до 473 К – ∆S5 .
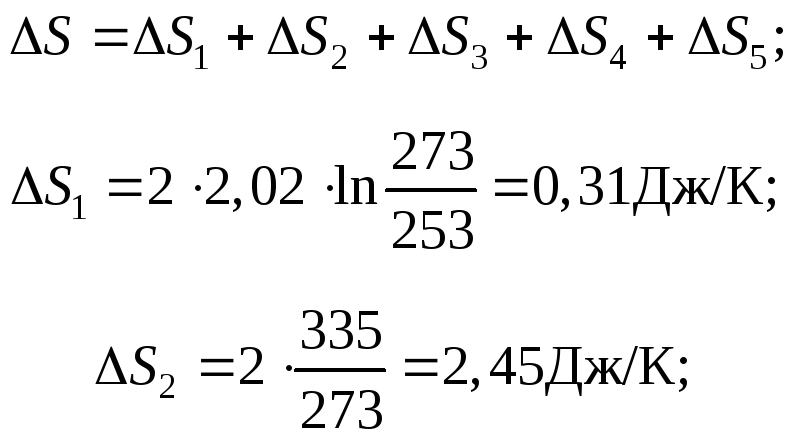
![]()
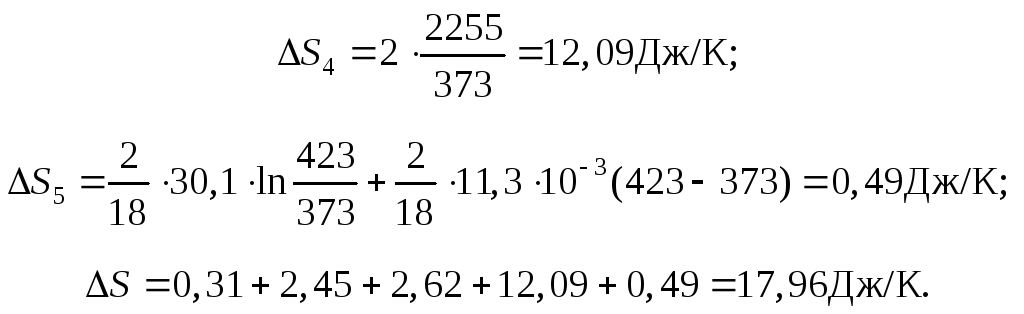
Пример 7
В одном из сосудов вместимостью 0,1 м3 находится кислород, в другом, вместимостью 0,4 м3 – азот. В обоих сосудах температура 290 К и давление 1,013 · 105 Н/м2 . Найти изменение энтропии при смешении газов, считая их идеальными.
Решение
Находим числа моль газов по уравнению Менделеева – Клапейрона:
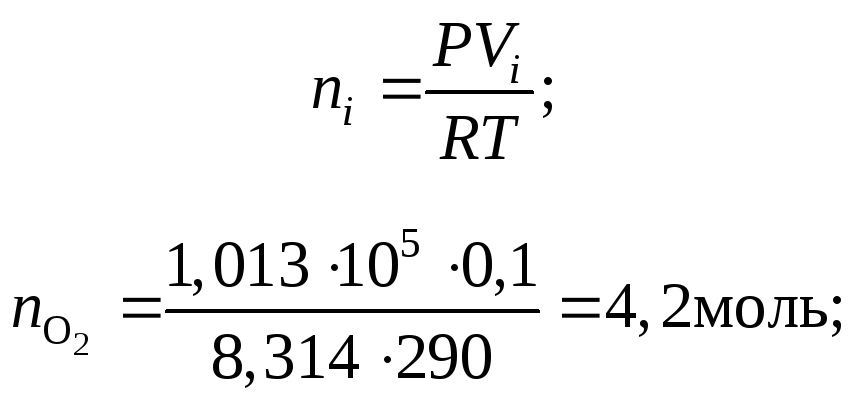
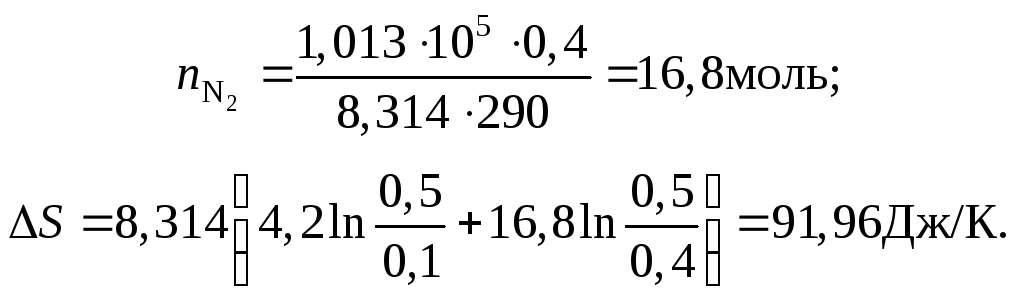
Пример 8
Вычислить
стандартное изменение энтропии
![]() для реакции:Cd+2AgCl
= 2Ag+CdCl2 ,
если
для реакции:Cd+2AgCl
= 2Ag+CdCl2 ,
если
![]()
![]()
![]()
![]()
Решение