
ЛР 4 кор
.pdf1
ЛАБОРАТОРНА РОБОТА № 4
ТЕМА: ВИДІЛЕННЯ ЧИСТИХ КУЛЬТУР БАКТЕРІЙ. ВИВЧЕННЯ КУЛЬТУРАЛЬНИХ ВЛАСТИВОСТЕЙ БАКТЕРІЙ. МЕТОДИ ІДЕНТИФІКАЦІЇ МІКРООРГАНІЗМІВ
1. МЕТА РОБОТИ:
Ознайомитися з методикою виділення чистих культур мікроорганізмів та методикою посіву бактерій на щільні і рідкі живильні середовища. Ознайомитися з методикою вивчення властивостей чистої культури бактерій, з принципами ідентифікації бактерій.
В результаті виконання даної роботи студент має ЗНАТИ: методики виділення чистих культур мікроорганізмів, посіву
бактерій на щільні і рідкі живильні середовища, вивчення властивостей виділеної чистої культури бактерій, принципи ідентифікації мікроорганізмів.
ВМІТИ:
1. Провести пересівання бактерій на щільні поживні середовища (МПА, МПБ та ін.).
2. Зробити посів із суспензії змішаних культур мікроорганізмів за методом Дрігальского для виділення чистої культури.
3.Описати морфологічні властивості ізольованою колонії (форма, колір і т. і.).
4.Приготувати фіксований препарат ізольованої культури, забарвити за методом Грама.
2. Самостійна підготовка до заняття
За підручниками та лекційним курсом ознайомитися з теоретичним матеріалом по темі лабораторної роботи.
3. Матеріали та обладнання:
Суспензія змішаних культур мікроорганізмів, пробірки з чистими бактеріальними культурами для посіву; живильні середовища (ЖС): МПА (м’ясо-пептонний агар), МПБ (м’ясо-пептонний бульон), Кітта-Тароцці в пробірках; набір розчинів фарб для фарбування за Грамом; бактеріологічні петлі, стерильні піпетки Пастера, чашки Петрі, стерильний шпатель, маркери, предметні скельця, фільтрувальний папір, мікроскопи, спиртові або газові пальники.
2
4. Запитання та завдання для самоперевірки.
1.Розкрийте поняття «чиста культура мікроорганізму» та назвіть основні методи її ізоляції (виділення).
2.Для чого вивчають культуральні властивості бактерій?
3.За якими критеріями описують морфологічні ознаки мікроорганізму?
4.На які групи поділяють мікроорганізми за відношенням до кисню?
5.Назвіть основні категорії мікроорганізмів за типом живлення?
6.Які ви знаєте методи біохімічної ідентифікації?
7.Як визначається протеолітична здатність мікроорганізмів?
8.Назвіть методи визначення цукролітичної здатності бактерій.
9.В чому полягає принцип молекулярно-генетичної ідентифікації?
10.Назвіть правила посіву (пересіву) чистих культур.
Терміни та скорочення Колонія - це видиме ізольоване скупчення, що утворюється при
розмноженні однієї колонієутворюючої одиниці (КУО) на щільному живильному середовищі (на поверхні або у глибині). Колонії бактерій різних видів відрізняються одна від одної за своєю морфологією, кольором та іншими культуральним ознаками.
Поживне (живильне) середовище (culture medium) — субстанція,
яка використовується для лабораторного вирощування організмів. В наш часвідомо безліч стандартних біологічних поживних середовищ. Основа багатьох середовищ, які використовуються, зокрема, для культивування бактерій, бактеріофагів, личинок дрозофіл і т.п. - агар. За набором специфічних компонентів можуть бути виділені мінімальне середовище, селективне середовище та ін.
МПБ, МПЖ, МПА - м'ясо-пептонний: бульон, желатин, агар. Склад поживних середовищ, що використовуються для культивування мікроорганізмів.
Штам (нім. Stamm, буквально — стовбур, основа), чиста культура певного виду мікроорганізмів, у якої вивчені морфологічні і фізіологічні особливості. Штами можуть бути виділені з різних джерел (ґрунту, води, харчових продуктів і т. д.) або з одного джерела в різний час. Тому один і той же вид бактерій, дріжджів, мікроскопічних грибів може мати велике число штамів, що відрізняються за рядом властивостей, наприклад за чутливістю до антибіотиків, здатністю до утворення токсинів, ферментів та інших факторів. Штами мікроорганізмів, що вживаються в промисловості для мікробіологічного синтезу білків (зокрема ферментів), антибіотиків, вітамінів, органічних кислот тощо, значно продуктивніші (в результаті селекції) за дикі штами.Створені штами мікроорганізмів, які в промислових масштабах продукують білки, вітаміни, лікарські препарати, вакцини й інші необхідні людині речовини.
3
5. Теоретичне обґрунтування Чиста культура - (або аксенічна культура) сукупність мікроорганізмів
(МКО) одного виду, що мають однакові морфологічні, біохімічні та культуральні властивості.
Виділення чистої культури є основою роботи з бактеріями, бо часто зразки, що досліджуються, містять суміш різних видів мікроорганізмів. Вивчення властивостей мікроорганізмів і встановлення їх видової приналежності можливо тільки за наявності чистої культури.
Основним завданням для виділення чистих культур з матеріалу, що містить суміш різних МКО, є отримання окремих бактеріальних колоній (потомство однієї клітини на щільному живильному середовищі).
Для виділення та розмноження культури бактерій з досліджуваного матеріалу (молоко, м'ясо, вода, грунт і т.д.) у лабораторіях використовують метод посіву та пересіву. Посівом (інокуляцією) називається внесення МКО у (на) стерильне живильне середовище, пересівом (пасажем) - перенесення частки культури МКО, що виросла на одному живильному середовищі, на інше, нове стерильне живильне середовище (рис. 1).
Рис.1 . Пересів з однієї пробірки в іншу
Для розділення культур МКО, які отримані з матеріалів, що часто містять суміші МКО, використовують різні методи: механічні, хімічні та біологічні.
Методи механічного розділення мікроорганізмів. Метод Пастера
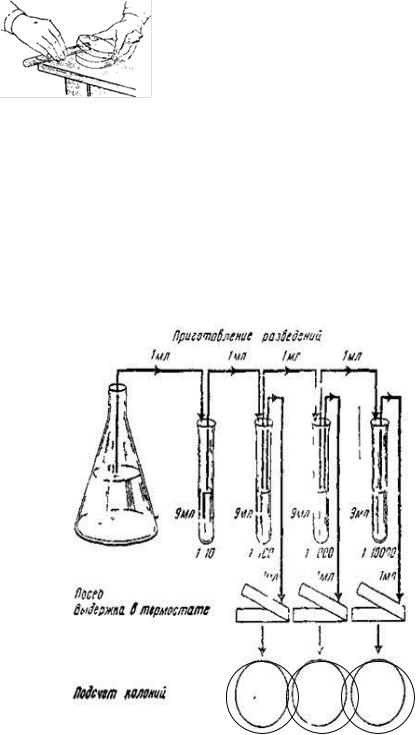
(метод розбавлень) полягає в тому, що зі зразку, що досліджується, роблять ряд послідовних розведень в рідкому живильному середовищі: краплю посівного матеріалу вносять в колбу (пробірку) зі стерильною поживною рідиною (МПБ та ін.), з неї краплю переносять у наступну і т. д. до 8 - 10 ємностей. З кожним розведенням кількість мікробних клітин, що потрапляють в середовище, буде зменшуватися, і можна отримати такі розведення (останні), коли у колбі (пробірці) з середовищем буде знаходитися тільки одна мікробна клітина. У рідких середовищах мікроорганізми мають дифузний розвиток, тобто легко поширюються за об’ємом середовища, завдяки чому ізолювати одну мікробну клітину від іншої буде важко. Для ізолювання чистих культур цей метод у сучасній мікробіології не застосовують, його використовують лише для попереднього зменшення концентрації МКО у зразках перед роботою зі щільними ЖС.
4
Метод Коха. Досліджуваний матеріал вносять бактеріологічною петлею або пастерівською піпеткою в пробірку з розплавленим МПА (агаром) або МПЖ (желатином). Рівномірно розмішують його, обертаючи пробірку між долонями. Краплю розведеного матеріалу переносять у другу пробірку, з другої у третю і т. д. (кількість розведень залежить від передбачуваної кількості МКО у зразку). Вміст кожної пробірки, починаючи з першої, виливають у окремі стерильні чашки Петрі (рис. 2).
Рис. 2. Розлив агару в чашки Петрі
Після застигання середовища чашки розміщують у термостаті догори дном, щоб конденсат не осідав на поверхні середовища.
За посіву мікроорганізмів на щільне середовище вони не можуть розповсюджуватися по всьому середовищу, як це має місце у рідині, а розмножуються тільки на тому місці, куди спочатку потрапили. З кожної життєздатної клітини утворюється скопичення мікроорганізмів - колонія,
яку видно неозброєним оком. |
|
|
||||
У даний час цей метод |
|
|||||
застосовується |
для |
виділення |
|
|||
чистих культур рідко, але має |
|
|||||
велике |
значення |
для кількісного |
|
|||
обліку МКО у певному обсязі |
|
|||||
матеріалу, |
що |
вивчається. |
|
|||
Принцип його полягає у тому, що |
|
|||||
в |
порожню |
стерильну |
|
|||
бактеріологічну чашку |
вноситься |
|
||||
точно виміряна кількість (частіше |
|
|||||
від 0,5 до 1 см3) бактеріальної |
|
|||||
суміші, |
після |
чого |
чашка |
|
||
заливається |
розплавленим |
і |
|
|||
охолодженим до 45 - 48 °С МПА. |
|
|||||
Після ретельного |
перемішування |
|
||||
посівного |
матеріалу |
з |
|
|||
середовищем і застигання агару, |
|
|||||
посіви розташовують у термостаті |
|
|||||
і культивують за оптимальної для |
|
|||||
мікроорганізмів температури (рис. 3). |
Рис. 3. Посів методом Коха |
|||||
5
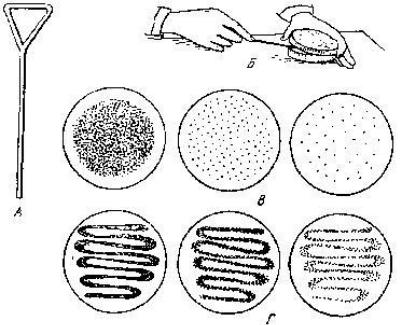
Метод Дригальского заснований на механічному роз’єднанні мікробних клітин на поверхні щільного живильного середовища. Кожна мікробна клітина, фіксуючись на тому місці, куди вона потрапила, починає розмножуватися і через 2-3 дні утворює колонію. Колонія утворюється шляхом ділення однієї клітини і, у зв'язку з цим, являє собою чисту культуру мікроорганізму.
Для посіву за методом Дригальского використовують кілька чашок Петрі, залитих щільним ЖС. На поверхню застиглого середовища в першу чашку вносять краплю досліджуваного матеріалу, що містить мікроорганізми (рис. 4). Потім за допомогою скляного шпателя або бактеріологічної петлі краплю розтирають по всій поверхні середовища. Цим же шпателем (не обпалюючи його) проводять по поверхні середовища в другій і в третій чашках. У процесі розтирання мікробні клітини роз’єднуються. Після посіву на кришках чашок роблять нотатку: найменування матеріалу, що досліджується, номер аналізу, дату посіву та номер чашки, прізвище студента. Звичайно, у першій чашці з’являються МКО у вигляді суцільного нальоту. У наступних кількість колоній зменшується і зустрічаються ізольовані, з яких легко виділити чисту культуру.
Рис . 4. Посів методом Дригальського:
а – шпатель Дригальського; б – посів; в – ріст мікроорганізмів після розсіву шпателем; г – ріст мікроорганізмів після розсіву петлею.
Метод нагрівання зразків, що досліджуються, застосовується для виділення чистих культур спорових форм МКО (гнійних, маслянокислих бактерій та ін.) Перед посівом матеріал прогрівають на водяній бані за
6
температури 75 - 85 °С протягом 20 - 30 хв. Вегетативні форми гинуть під час прогрівання, а спори мікробів залишаються живими і при подальших висівах на щільне середовище проростають та формують колонії.
Метод виділення чистих культур за допомогою хімічних речовин.
Метод використовується для ізолювання культур мікроорганізмів, стійких до певних хімічних речовин.
Зокрема, такий метод використовується для виділення культур палочок Коха - Mycobactérium tuberculósis (лат.), які стійкі до дії кислот, лугів і спирту. Матеріал перед посівом заливають 15 % розчином кислоти або антиформіном і витримують у термостаті до 4 год. Після впливу кислоти або лугу клітини збудника туберкульозу залишаються живими, оскільки вони кислото- і лугостійкі, а всі інші мікроорганізми гинуть. Після нейтралізації кислоти або лугу, висівають зразок на щільне ЖС та отримують тільки колонії збудника туберкульозу.
Методи збагачення часто застосовують для виділення чистих культур різних МКО (наприклад, сальмонел та ін.) з матеріалів, у яких мало клітин бактерій, що досліджуються, але додатково міститься велика кількість супутньої мікрофлори. Для збільшення чисельності виду, який має бути виділеним у чисту культуру, спочатку роблять посів досліджуваного матеріалу на поживні середовища, які містять речовини, що стимулюють розвиток цього виду МКО, і, на той же час, пригнічують або затримують розмноження супутньої мікрофлори. Зокрема, для виділення сальмонел проводять посів у середовища збагачення Кауфмана, Мюллера та ін. Для виділення культур молочнокислих бактерій з грунту або рослин посіви роблять на стерильне знежирене молоко, що містить 5 % етилового спирту для призупинення зростання гнійних бактерій.
Після культивування на накопичувальному середовищі проводиться висів на щільні поживні середовища в чашки Петрі для виділення чистих культур шуканих мікроорганізмів методами Коха або Дригальського.
Біологічний принцип роз’єднання бактерій передбачає цілеспрямований пошук методів, які враховують численні особливості мікробних клітин. Серед найпоширеніших методів можна виділити наступні:
1.За типом дихання. Всі мікроорганізми за типом дихання поділяються на дві основні групи: аеробні (Corynebacterium diphtheriae, Vibrio сholerae тощо) таанаеробні (Clostridium tetani, Clostridium botulinum, Clostridium perfringens та ін.). Якщо матеріал, з якого слід виділити анаеробні збудники, попередньо прогріти, а потім культивувати
ванаеробних умовах, то виростуть саме ці бактерії.
2.За спороутворенням. Відомо, що деякі мікроби (бацили і клостридії) здатні до спороутворення. Серед них Clostridium tetani, Clostridium botulinum, Clostridium perfringens, Bacillus subtilis, Bacillus
7
cereus. Спори стійкі до дії факторів зовнішнього середовища. Отже, досліджуваний матеріал може бути підданий дії термічного фактора, а потім інокулятивно перенесений в живильне середовище. Через деякий час на ньому виростуть саме ті бактерії, які здатні до
спороутворення. |
|
|
|
|
|
|
3. Стійкість |
мікробів |
до |
дії |
кислот |
і |
лугів. Деякі |
мікроби (Mycobacterium tuberculosis, |
Mycobacterium |
bovis) внаслідок |
||||
особливостей їх хімічної будови стійкі до дії кислот. Ось чому матеріал, який їх містить, наприклад, харкотиння при туберкульозі попередньо обробляють рівним об’ємом 10 % розчину сірчаної кислоти, а потім висівають на живильні середовища. Стороння флора гине, а мікобактерії внаслідок їх резистентності до кислот, виростають.
Холерний вібріон (Vibrio сholerae), навпаки, є галофільною бактерією, тому для створення оптимальних умов росту його висівають на середовища, які містять луг (1 % лужна пептонна вода). Вже через 4-6 год на поверхні середовища з’являються характерні ознаки росту у вигляді ніжної голубуватої плівки.
4. Рухомість бактерій. Деякі мікроби (Proteus vulgaris) мають тенденцію до повзучого росту і здатні швидко розповсюджуватись по поверхні дещо вологого середовища. Для виділення таких збудників їх засівають у краплинку конденсаційної рідини, яка утворюється при
охолодженні |
стовпчика |
скошеного |
агару. |
Через |
|
16-18 |
год вони розповсюджуються |
на всю поверхню середовища. |
Якщо |
||||
взяти матеріал з верхньої частини агару, будемо мати чисту |
культуру |
|||||
збудників. |
|
|
|
|
|
|
5.Чутливість мікробів до дії хімічних речовин, антибіотиків та інших протимікробних засобів. Внаслідок особливостей метаболізму бактерій вони можуь мати різну чутливість до деяких хімічних чинників. Відомо, що стафілококи, аеробні бацили, що утворюють спори, стійкі до дії 7,5–10 % хлориду натрію. Ось чомудля виділення цих збудників використовують елективні живильні середовища (жовтково-сольовий агар, маніт-сольовий агар), які містять саме цю речовину. Інші бактерії при такій концентрації хлориду натрію практично не ростуть.
6.Введення деяких антибіотиків (ністатин) використовується для гальмування росту грибів у матеріалі, який сильно контамінований ними. І, навпаки, додавання антибіотика пеніциліну до середовища сприяє інгібуванню росту бактеріальної флори, якщо треба виділити гриби. Додавання фуразолідону в певних концентраціях до живильного середовища створює селективні умови для росту коринебактерій і мікрококів.
8
7.Здатність мікроорганізмів проникати через неушкоджені шкірні покриви. Деякі патогенні бактерії (Yersinia pestis) внаслідок наявності великої кількості ферментів агресії здатні проникати через непошкоджену шкіру. Для цього шерсть на тілі лабораторної тварини голять і в цю ділянку втирають досліджуваний матеріал, який містить збудника і велику кількість стороньої мікрофлори. За деякий час тварину забивають, а з крові або внутрішніх органів виділяють МКО.
8.Чутливість лабораторних тварин до збудників інфекційних захворювань. Окремі тварини проявляють високу чутливість до різних
мікроорганізмів. |
Наприклад, |
при |
будь-якому |
способі |
|
введення Streptococcus pneumoniae білим мишам у них |
розвивається |
||||
генералізована |
пневмококова |
інфекція. |
Аналогічна |
картина |
|
спостерігається при зараженні гвінейських свинок |
збудниками |
||||
туберкульозу (Mycobacterium tuberculosis). |
|
|
|
||
ВИВЧЕННЯ КУЛЬТУРАЛЬНИХ: МОРФОЛОГІЧНИХ, ФІЗІОЛОГІЧНИХ ТА БІОХІМІЧНИХ ВЛАСТИВОСТЕЙ БАКТЕРІЙ. ВИЗНАЧЕННЯ ВИДУ МІКРООРГАНІЗМУ.
Після ізоляції чистої культури мікроорганізму необхідно визначити його видову належність. Для цього проводять вивчення ряду властивостей виділеної культури: морфологічних, фізіологічних та ферментативних.
Культуральні властивості визначають за характером росту мікробної культури на щільному і рідкому середовищі, яка характеризується як морфологічними так і фізіологічними ознаками. Визначення виду збудників за їх культуральними ознаками називають культуральною ідентифікацією. Для видового визначення культур молочнокислих бактерій, крім того, перевіряють активність і межу кислотоутворення в молоці, розвиток у молоці за умов 40-45 °С, стійкість до пеніциліну, жовчі, хлориду натрію, фенолу та ін.. Для ідентифікації деяких мікроорганізмів вивчають також антигенні властивості. Для встановлення виду збудників захворювань обов’язково визначають рівень патогенності на лабораторних тваринах.
Вивчення морфології бактерій та їх колоній.
Морфологічне вивчення колоній проводять або за допомогою лупи, або безпосередньо під мікроскопом та описують наступні характеристики
1.Форма колоній: точкова, кругла, неправильна, коренеподібна, еліпсоподібна і т. і. (рис. 6).
2.Діаметр колоній (у мм). Прийнято вважати колонії до 1 мм точковими, або карликовими, з діаметром 1 - 2 мм - дрібними, 2 - 4 мм середніми і з діаметром більше 4 мм - великими.

9
Рис. 6. Морфологічна характеристика бактеріальних колоній
3.Колір, який обумовлюється пігментом: білий, червоний, синьозелений, жовтий, оранжевий і т.і.. Мікроорганізми, що не утворюють пігменту, мають колонії сірувато-білі (безбарвні).
4.Рельєф колоній (плоскі, опуклі, куполоподібні, плоскоопуклі, з піднятим або утисненим центром, піднятими краями і т.д.).
5.Поверхня: гладка, зморшкувата, покреслена, бородавчаста, шорстка, звивиста і т.і.. Блиск поверхні: блискуча, матова, тьмяна. Поверхню колоній вивчають спочатку неозброєним оком, а потім за допомогою лупи чи малого збільшення мікроскопа. Гладенькі колонії позначають як S- форми (smooth - гладенький), а шорсткі - R-форми (rough - шорсткий, нерівний).
6.Прозорість: прозора, непрозора, напівпрозора.
7.Характер країв колоній: рівні, хвилясті, часточкові, локоноподібні, лопатеві, бахромчаті, зазубрені, коренеподібні, розпливчасті і т.і.).
8.Структура колоній: дрібно- і грубозерниста (гетерогенна), радіально і концентрично покреслена, строката, луската, струйчата, гомогенна. Краї і структуру колоній визначають шляхом мікроскопіювання за збільшення х8 .
9.Консистенція: слизова, суха, мазеподібна, тістоподібна, крихтоподібна і т.і.; її можна визначити доторканням до колонії бактеріологічною петлею.
Морфологічні |
властивості |
бактерій |
вивчають |
шляхом |
10
микроскопіювання забарвлених мазків бактеріальної колонії. Протягом аналізу визначають форму мікробних клітин, характер їх розташування, наявність спор, капсул, тинкторіальну здатність (фарбування за методом Грама), визначають чистоту культури. Окрім перегляду забарвлених мазків, встановлюють наявність джгутиків шляхом дослідження культур на рухливість в препаратах «висяча» або «роздавлена» крапля, а також шляхом посіву культури на напіврідкий мясопептонний агар (рухливі бактерії викликають помутніння агару, а нерухомі ростуть біля осередків інокуляції).
Фізіологічні методи засновані на вивченні особливостей розвитку МКО з використанням специфічних поживних середовищ. Для окислення органічних речовин з метою отримання енергії одні мікроорганізми використовують кисень повітря, інші здатні обходитися при цьому без кисню, а для третіх кисень повітря є навіть шкідливим. Отже, по відношенню до кисню повітря мікроорганізми можна поділити на аеробні — це ті мікроорганізми, які потребують кисню повітря, і анаеробні мікроорганізми, яким кисень повітря не потрібен.
Серед анаеробних мікробів зустрічаються суворі, або безумовні, анаероби, на них кисень повітря діє згубно, і факультативні, або умовні, анаероби, здатні існувати як у присутності кисню, так і без нього.
Бактерії здатні викликати дифузне помутніння середовища, колір його при цьому може не змінюватись або набуває кольору пігменту. Такий характер росту найчастіше спостерігається у більшості факультативноанаеробних мікроорганізмів.
Деколи відбувається утворення осаду на дні пробірки. Він може бути крихтоподібним, гомогенним, в’язким, слизистим та ін. Середовище над ним може залишатись прозорим або ставати мутним. Якщо мікроби пігменту не утворюють, осад має сірувато-білий або жовтуватий колір. Подібним чином ростуть, як правило, анаеробні бактерії.
Пристінковий ріст проявляється утворенням пластівців, зерен, прикріплених до внутрішніх стінок пробірки. Середовище при цьому залишається прозорим.
Аеробні бактерії мають тенденцію до поверхневого росту. Часто утворюється ніжна безбарвна або голубувата плівка у вигляді ледь помітного нальоту на поверхні, яка зникає при струшуванні або збовтуванні середовища. Плівка може бути волога, товста, мати в’язку, слизисту консистенцію та прилипати до петлі, тягнучись за нею. Однак, зустрічається й щільна, суха, крихка плівка, колір якої залежить від пігменту, що виробляється мікроорганізмами. Аеробні мікроорганізми в процесі дихання звичайно окислюють органічні речовини повністю до утворення в якості кінцевих продуктів вуглекислого газу і води. До числа
