
- •Методичні вказівки
- •2. Правила оформлення звітів
- •3.Техніка безпеки та охорона праці при виконанні лабораторних робіт
- •Лабораторна робота № 1 Експериментальне дослідження процесів електролізу
- •Загальні відомості
- •Лабораторне обладнання, інструменти і матеріали
- •Методика виконання роботи
- •Література
- •Лабораторна робота № 2 Вивчення фотохімічних властивостей світлочутливих матеріалів
- •Загальні відомості
- •Лабораторне обладнання, інструменти і матеріали
- •Методика виконання роботи
- •Оцінка якості зображення.
- •Розрахункові роботи
- •Визначення теплового ефекту реакції
- •Розрахунки коефіцієнта корисної дії теплової машини
Оцінка якості зображення.
На пластинах з різними експозиціями з використанням мікроскопу МИМ-7 визначають роздільну та виділяючи здатність.
Для визначення роздільної здатності достатньо виміряти мінімальний штрих і пробіл між штрихами. Роздільна здатність на довжині 1см буде визначатися по формулі
ρ = 10000/l,
де l – сума ромірів штриха і пробілу в мкм.
Виділяюча здатність визначається простим вимірюванням мінімальної ширини штриха.
По результатам проведених досліджень будуємо графік залежності роздільної здатності (виділяючої здатності) від часу експонування визначаємо оптимальний час експонування фоторезисту в описаних умовах. Зробити висновок.
Час експонування буде відповідати максимальному значенні роздільної здатності і мінімальному значенні виділяючої здатності.
Розрахункові роботи
Визначення теплового ефекту реакції
Теплові ефекти реакції можна визначити на основі закону Гесса, згідно якого тепловий ефект реакції не залежить від шляху переходу при збереженні постійними початкових і кінцевих умов досліду (р,V). Якщо речовини А, В, С, перетворюються в D, E, F, то будемо мати такі рівняння.
Q3
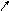
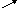
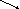
 Q2 Q4
Q2 Q4
Q1
А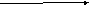

 ,
В, С D,
E,
F
,
В, С D,
E,
F
Q5 Q8

 Q6
Q7
Q6
Q7
Q1= Q2 + Q3 + Q4 = Q5 + Q6 + Q7 + Q8
При рішенні термохімічних рівнянь їх можна складати і віднімати, як і при рішенні алгебраїчних рівнянь. При розрахунках теплових ефектів особливо важливі є два теплових ефекти:
теплота утворення;
теплота згоряння.
Теплотою утворення називається тепловий ефект реакції утворення хімічних сполук із складових його простих речовин, стійких при даних умовах. Теплота утворення SiO2 = 210тис. кал. або 210 Ккал. Це значить що при з'єднанні одного атома кремнію і 1 моля кисню виділяється тепло 210 Ккал.
Si + O2 = SiO2 = 210000 Кал; ΔН0sio2 = - 210 Ккал.
Теплоти, як правило, відносять до 1 моля утвореної сполуки. Значення теплових ефектів дають при 250 С і при тиску 1 атмосфера Теплотою згоряння називається тепловий ефект реакції взаємодії речовини з киснем з утворенням стабільних окислів ( Н2О; СО2; SiO2). Теплота згоряння дорівнює різниці між теплотами згоряння продуктів реакції і теплотами згорання вихідних речовин. Але ця різниця повинна бути взята з протилежним знаком.
Знаючи теплоту згорання алмазу і графіту, можна розрахувати теплоту перетворення графіту в алмаз, бо експериментально це важко визначити.
С графіту.+ О2 = СО2 +94 Ккал
С алмазу + О2 = СО2 +94,5 Ккал
С граф. = С алмаза – 500 кал
1) Розглянемо реакцію одержання А12(SР4)3 при t = 250С з кристалічного А12О3 і газоподібного SО3. Напишемо термохімічне рівняння реакції утворення всіх речовин.
А12О3 + 3 SО3 → А12 (SО4)3
ΔН0утворення 298 0К\моль
Q утворення = - 400 Ккал\ моль = - 821000 кал\моль
ΔН х = Σ ( nΔН утвор)кінц - Σ ( nΔН утвор)поч..
n – кількість молей
ΔН х = - ( 1 * ( - 400400кал \ моль) + 3 * (- 94400кал \ моль )) + 1 * ( - 821 Ккал\ моль ) = - 137 Ккал \ моль
Розрахувати тепловий ефект реакції
Fe3 O4 + 4OC → 3 Fe +4OC2 , якщо теплові ефекти утворення складових реакції дорівнюють:
Fe3 O4 = -266,9 Кал
СО = - 26,42 Ккал
ΔН х = -3,82 Кал
OC2 = - 94,1 Кал
Fe =0 кал
Підставляючи ці значення в формулу
ΔН х утв. = (qΔН утвQ + r ΔН утв R) – (bΔН утвB + dΔН утв D), знаходимо, що тепловий ефект реакції ΔН х = -3,82 Кал
Відповідь :ΔН х = - 3,82 Кал
