
monomers-Платэ-книга
.pdf
|
|
|
|
|
|
|
|
121 |
|
|
|
|
|
|
|
тепла, О2, О3, го- |
|
|
ров акриловой |
|
C(O)OR |
CN |
тали и др., РТИ, |
|||
|
кислоты друг с |
|
|
|
|
|
рячим, в т.ч. се- |
изоляция про- |
|
другом или с |
|
|
|
|
|
росодержащим |
водов и кабе- |
|
акрилонитри- |
|
|
|
|
|
маслам и смаз- |
лей, цветостой- |
|
лом |
|
|
|
|
|
кам, к порезам, |
кие резины, |
|
|
|
|
|
|
|
газонепроницае- |
ударопрочные |
|
|
|
|
|
|
|
мость, адгезион- |
пластики, адге- |
|
|
|
|
|
|
|
ные показатели |
зивы, покрытия, |
|
|
|
|
|
|
|
|
клеи и др. |
|
|
|
|
|
|
|
Продолжение табл. 4.1. |
|
|
1 |
2 |
|
|
3 |
4 |
||
Уретановые |
Полиуретаны, по- |
[- |
СNНR'НСОRО-]n |
Высокие проч- |
РТИ (в т. ч. |
|||
каучуки |
лучаемые взаимо- |
|
O |
O |
|
ность, износо- |
цветные и про- |
|
СКУ |
действием поли- |
|
|
|
|
|
стойкость, масло- |
зрачные), изно- |
|
эфиров с конце- |
|
|
|
|
|
и бензостойкость, |
состойкие по- |
|
выми ОН- |
|
|
|
|
|
устойчивость к |
крытия, мас- |
|
группами |
|
|
|
|
|
действию света, |
сивные шины, |
|
и диизоцианатов |
|
|
|
|
|
озона, радиации, |
низ обуви, ис- |
|
|
|
|
|
|
|
вибростойкость |
кусственная |
|
|
|
|
|
|
|
|
кожа, герметики |
|
|
|
|
|
|
Высокие проч- |
|
|
Хлорсульфи- |
Полиэтилен. |
~{[-(СН2)3СНСl(СН2)2-]12- |
РТИ, изоляция |
|||||
рованный по- |
Содержащий |
-СН2 |
CH-}17~ |
|
|
ность, износо- |
проводов и ка- |
|
лиэтилен |
хлор- |
|
SO2Cl |
|
|
стойкость, тепло- |
белей, резино- |
|
ХСПЭ |
сулъфоновые |
|
|
|
|
|
стойкость, стой- |
вая обувь, по- |
|
группы |
|
|
|
|
|
кость к действию |
крытия полов, |
|
|
|
|
|
|
|
озона, сильных |
белая боковина |
|
|
|
|
|
|
|
окислителей. аг- |
шин, лаки и |
|
|
|
|
|
|
|
рессивных сред, |
краски, проре- |
|
|
|
|
|
|
|
кипящей воды, |
зиненные ткани, |
|
|
|
|
|
|
|
минеральных ма- |
обкладка валов |
|
|
|
|
|
|
|
сел, хорошие |
и хим. аппара- |
|
|
|
|
|
|
|
дизлектрические |
туры |
|
|
|
|
|
|
|
св-ва, совмести- |
|
|
|
|
|
|
|
|
мость с другими |
|
|
|
|
|
|
|
|
каучуками |
|
|
|
|
|
|
|
Высокие стой- |
|
|
Пропилен- |
Сополимер |
[-СН2СН(СН3)-О-]n- |
Прокладки, |
|||||
оксидный кау- |
пропиленоксида |
-{-СН2 |
СН-O-]m |
|
кость к действию |
шланги, амор- |
||
чук СКПО |
с 2-8% (мол.) |
|
СH2ОCН2СН=СН2 |
озона, щелочей, |
тизаторы, авто- |
|||
|
аллил- |
|
|
|
|
|
воды. прочность, |
детали и др., |
|
глицидилового |
|
|
|
|
|
эластичность, |
прорезиненные |
|
эфира |
|
|
|
|
|
температуро-, те- |
ткани, озоно- |
|
|
|
|
|
|
|
пло- и морозо- |
стойкие покры- |
|
|
|
|
|
|
|
стойкость, удов- |
тия |
|
|
|
|
|
|
|
летворительные |
|
|
|
|
|
|
|
|
маслостойкость и |
|
|
|
|
|
|
|
|
износостойкость |
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
122 |
|
|
|
Эпихлоргид- |
|
[-СН2-СН(СН2С1)-О-]n |
|
Высокие масло-, |
|
РТИ, авто- и |
|
|
Гомо- и сопо- |
|
|
|
||||
|
риновый кау- |
лимеры эпи- |
-[-СH2СН2О-]m |
|
бенэо-, озоно-, |
|
авиадетали, ру- |
|
|
чук СКЭХГ |
хлор-гидрина с |
|
|
свето- и термо- |
|
кава, уплотни- |
|
|
|
этилен-оксидом |
|
|
стойкость, газо- |
|
тели, проклад- |
|
|
|
|
|
|
непроницаемость, |
|
ки, детали хо- |
|
|
|
|
|
|
прочность связи с |
|
лодильных ус- |
|
|
|
|
|
|
металлами, него- |
|
тановок, герме- |
|
|
|
|
|
|
рючесть (гомопо- |
|
тики |
|
|
|
|
|
|
лимер), удовле- |
|
|
|
|
|
|
|
|
творительная мо- |
|
|
|
|
|
|
|
|
розостойкость |
|
|
|
Каучуки общего назначения, как и натуральный каучук, используются для производства шин, различных резинотехнических изделий, от которых не требуется масло- и бензостойкость, стойкость к агрессивным средам, высоким температурам и т.д. Наиболее массовыми каучуками общего назначения являются 1,4-цис-изопреновый и 1,4-цис-бутадиеновый, доля которых в общем производстве синтетических каучуков приближается к 60%.
Каучуки специального назначения, резины из которых по отдельным показателям существенно превосходят эластомеры общего назначения, выпускаются в значительно меньшем объеме, но в более широком ассортименте.
4.1. БУТАДИЕН-1,3
Бутадиен-1,3 (дивинил) СН2=СН—СН=СН2 - бесцветный газ с характерным неприятным запахом с темп. кип. 268,59 К.
Бутадиен - типичный диеновый углеводород с сопряженными двойными связями, легко полимеризуется и сополимеризуется со стиролом, нитрилами или эфирами акриловой или метакриловой кислот, винил- и метилвинилпиридинами, винил- и винилиденхлоридами, изобутиленом, изопреном и др. Бутадиен является основным мономером, применяемым в современном промышленном производстве синтетических каучуков. На бутадиене базируется производство подавляющего большинства синтетических каучуков общего назначения: стереорегулярные 1,4,-цис-бутадиеновые, бутадиен-стирольные, бутадиен-метилстирольные, ряд синтетических каучуков специального назначения - бутадиен-нитрильные, бутадиенметилвинилпиридиновые и др. Помимо производства синтетических каучуков, бутадиен применяется в промышленном масштабе для производства синтетических смол, адиподинитрила (в производстве полиамидов) и себациновой кислоты.
Впервые процесс получения бутадиена из этилового спирта был разработан С.В. Лебедевым (СССР). Впоследствии он получил развитие в США.
Процесс производства бутадиена по реакции ацетилена с формальдегидом (способ Реппе) впервые был реализован в Германии. Затем были разработаны процессы получения бутадиена через альдольную конденсацию ацетальдегида (Германия) и дегидратацией и дегидрированием этанола (Советский
123
Союз, США). В настоящее время бутадиен получают из нефтяного сырья выделением из фракции С4 парового крекинга и дегидрированием бутана и частично бутена, также содержащихся во фракции С4 парового крекинга.
4.1.1. Способ С.В. Лебедева
На первых заводах синтетического каучука, построенных в Советском Союзе еще в начале 30-х годов, бутадиен получали по способу С.В. Лебедева путем каталитического разложения этилового спирта. На основе этого процесса в СССР впервые в мире было создано промышленное производство синтетического каучука. Процесс проводили в одну стадию:
2С2Н5ОН  С4Н6 + 2Н2О + Н2 Качественный состав продуктов реакции при превращении этанола в бу-
С4Н6 + 2Н2О + Н2 Качественный состав продуктов реакции при превращении этанола в бу-
тадиен свидетельствует о том, что в процессе протекают реакции конденсации, дегидрирования и дегидратации. Эти реакции проводят в одну стадию за счет использования полифункционального оксидного катализатора. Таким образом, в условиях превращения этанола реализуются следующие реакции:
дегидрирование спирта до ацетальдегида СН3СН2ОН 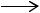 СН3СНО + Н2
СН3СНО + Н2
конденсации ацетальдегида в альдоль с последующим отщеплением воды и образованием кротонового альдегида
2СН3СНО СН3СН(ОН) СН2СНО
СН3СН(ОН) СН2СНО СН3СН=СНСНО + Н2О восстановление карбонильной группы кротонового альдегида водородом,
СН3СН=СНСНО + Н2О восстановление карбонильной группы кротонового альдегида водородом,
отдаваемым этиловым спиртом, с образованием кротилового спирта и ацетальдегида
СН3СН=СНСНО + С2Н5ОН 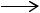 СН3СН=СНСН2ОН + СН3СНО дегидратация кротилового спирта, сопровождающаяся перегруппировкой
СН3СН=СНСН2ОН + СН3СНО дегидратация кротилового спирта, сопровождающаяся перегруппировкой
двойных связей с образованием бутадиена СН3СН=СНСН2ОН  СН2=СНСН=СН2 + Н2О
СН2=СНСН=СН2 + Н2О
Превращение спирта в бутадиен протекает при 633-653 К на неподвижном оксидном катализаторе. В качестве побочных продуктов образуются органические соединения различных классов: углеводороды, спирты, эфиры, альдегиды и др.
Теоретический выход бутадиена составляет 58,7%, однако, вследствие протекания побочных реакций он обычно бывает несколько ниже, но остается близким к теоретическому. Основным недостатком процесса является низкая селективность. Достоинство способа - сравнительная простота аппаратурного оформления технологического процесса. В настоящее время этот процесс в основном потерял промышленное значение.

124
4.1.2. Способ И.И. Остромысленского
Другой способ получения бутадиена, предложенный русским химиком И.И. Остромысленским еще в 1915 г., был реализован в США в годы Второй мировой войны. В отличие от способа С.В. Лебедева этот процесс протекает в две стадии.
На первой стадии дегидрированием этанола получают ацетальдегид:
С2Н5ОН |
СН3СНО + Н2 |
На второй стадии смесь спирта и ацетальдегида в мольном соотношении |
|
3:1 пропускают над катализатором (оксид тантала на силикагеле): |
|
СН3СНО + С2Н5ОН |
СН2 =СНСН=СН2 + 2 Н2О |
Селективность процесса – 63,9% от теоретической.
По этой технологии дегидрирование осуществляют при 523-573 К. В качестве катализатора используют медь, нанесенную на асбестовое волокно. В качестве промоторов к катализатору добавляют 5 % оксида кобальта и 2% оксида хрома (в расчете на медь). Выход ацетальдегида на пропущенный этанол составляет 30-40% при селективности ~ 92%. Основными побочными продуктами являются масляный альдегид, этилацетат и уксусная кислота.
Вторая стадия получения бутадиена по этому способу представляет собой совместное превращение этанола и ацетальдегида в присутствии в качестве катализатора оксида тантала, нанесенного на силикагель, при 603-623 К и атмосферном давлении. Синтез бутадиена протекает через стадию образования кро-
тонового альдегида: |
|
2CH3—CHO |
CH3—CH=CH—CHO + H2O |
CH3—CH=CH—CHO + CH3—CH2OH CH2=CH—CH=CH2 + CH3CHO + H2O
В годы Второй мировой войны по методу Остромысленского в США выпускалось ~ 60% всего бутадиена, использованного для производства синтетического каучука.
После 1952 г. все заводы, использовавшие этот процесс, были закрыты из-за их нерентабельности.
4.1.3.Получение бутадиена из ацетилена
ВГермании часть бутадиена производилась из ацетилена, который получали из карбида кальция. Были разработаны два многостадийных процесса:
-синтез бутадиена через альдоль - этот способ осуществлялся на заводах
ефирмы "И.Г. Фарбениндустри";
-синтез бутадиена через бутиндиол – этот способ был реализован, в частности, на заводе в г. Людвигсгафене фирмой БАСФ.
Синтез бутадиена через альдоль (альдольный метод)

125
Альдольный метод включает четыре стадии: гидратацию ацетилена до ацетальдегида, конденсацию ацетальдегида в альдоль, гидрирование альдоля до бутиленгликоля, дегидратацию бутиленгликоля в бутадиен.
Гидратация ацетилена в течение ряда лет являлась основным методом получения ацетальдегида, однако в последнее время этот процесс вытесняется методами, базирующимися на более дешевом сырье - этилене.
В промышленности используют метод получения ацетальдегида из ацетилена гидратацией в жидкой фазе в присутствии ртутных катализаторов (реакция Кучерова). Впервые в промышленном масштабе она была реализована в присутствии раствора сульфата двухвалентной ртути в серной кислоте:
СН СН + H2O 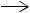 СН3СНО Н = 142 кДж/моль Сульфат ртути образуется непосредственно в реакторе гидратации из металлической ртути. Соль ртути образует с ацетиленом сложные промежуточные соединения, которые разлагаются на ацетальдегид и сульфат ртути. В связи с тем, что катализатор постепенно теряет активность, часть ртути выводится из реактора в виде шлама, а в реактор периодически вводят свежую металлическую ртуть. Синтез осуществляют при температуре ~373 К и давлении 0,25 МПа. Выход бутадиена достигает 90-97% от теоретического.
СН3СНО Н = 142 кДж/моль Сульфат ртути образуется непосредственно в реакторе гидратации из металлической ртути. Соль ртути образует с ацетиленом сложные промежуточные соединения, которые разлагаются на ацетальдегид и сульфат ртути. В связи с тем, что катализатор постепенно теряет активность, часть ртути выводится из реактора в виде шлама, а в реактор периодически вводят свежую металлическую ртуть. Синтез осуществляют при температуре ~373 К и давлении 0,25 МПа. Выход бутадиена достигает 90-97% от теоретического.
Жидкофазная гидратация ацетилена проводится при 348-368 К в присутствии 10-20% (мас.) серной кислоты и 0,5-1,0% (мас.) ртутного катализатора (в пересчете на HgО).
Высокая токсичность ртути привела к необходимости разработки процесса парофазной гидратации ацетилена над нертутными катализаторами. Наибольшую активность и стабильность проявляет кадмийкальцийфосфатный катализатор. Катализатор представляет собой смесь средних фосфатов кальция и кадмия, которая содержит некоторое количество кислых фосфатов при мольном соотношении (СаО + СdО):Р2О5, равном 2,8. Процесс проводят при 623 К. На поверхности катализатора в ходе процесса накапливаются смолистые вещества. Регенерацию катализатора осуществляют смесью воздуха и водяного пара при 673-703 К.
Конденсация ацетальдегида в альдоль проводится в присутствии 8-12%- ных растворов щелочи при атмосферном давлении и комнатной температуре:
2СН3СНО |
СН3СНОНСН2СНО |
Н = 72,2 кДж/моль |
|
Выход альдоля составляет ~ 50% на пропущенный и 84-88% на превра- |
|||
щенный ацетальдегид. |
|
|
|
Гидрирование альдоля в бутиленгликоль |
|
||
СН3СНОНСН2СНО + Н2 |
СН3СНОНСН2СН2ОН |
||
проводят при 328-343 К и давлении 30,0 МПа. В качестве катализаторов используют нанесенные на оксид алюминия или оксид кремния металлы: Со, Ni, Cu и другие.
Процесс дегидратации бутиленгликоля с получением бутадиена СН3СНОНСН2СН2ОН  СН2=СНСН=СН2 + 2Н2О Н = -118 кДж/моль
СН2=СНСН=СН2 + 2Н2О Н = -118 кДж/моль
126
осуществляют при 543-553 К и атмосферном давлении в присутствии разбавителя - водяного пара. В качестве катализатора используют кокс или графит, пропитанные фосфорной кислотой. Выход бутадиена на этой стадии ~ 47% за один проход или 97% от теоретического.
Синтез бутадиена через бутиндиол
Вгоды Второй мировой войны в Германии был разработан и реализован
впромышленности синтез бутадиена на основе ацетилена через бутиндиол. Бутиндиольный метод включает взаимодействие ацетилена и формальдегида с образованием 2-бутиндиола-1,4 и последующее гидрирование его в бутилендиол и бутандиол; бутандиол дегидрируют в бутадиен.
Основную стадию - конденсацию ацетилена с формальдегидом с образованием 2-бутиндиола-1,4 (метод Реппе) проводят при 373 К и 0,5 МПа.
СН СН + 2СН2О НОСН2-С С-СН2ОН Н = 231 кДж/моль
НОСН2-С С-СН2ОН Н = 231 кДж/моль
В качестве катализатора используют ацетиленид меди, нанесенный на силикагель. Формальдегид используют в виде 8%-ного водного раствора. Выход бутиндиола достигает по ацетилену около 80% и по формальдегиду около 90%.
Синтез бутиндиола протекает в две стадии.
На первой стадии образуется пропаргиловый спирт, который в присутствии катализатора присоединяет вторую молекулу формальдегида:
НС СН + СН2О |
СН С-СН2ОН, |
СН С-СН2ОН + СН2О |
НО—СН2-С С-СН2ОН. |
На второй стадии бутиндиол гидрируется с образованием бутандиола:
НОСН2-С С-СН2ОН + 2Н2  НОСН2СН2СН2СН2ОН + 252 кДж . Гидрирование водного раствора бутиндиола проводят при 423-473 К и 30
НОСН2СН2СН2СН2ОН + 252 кДж . Гидрирование водного раствора бутиндиола проводят при 423-473 К и 30
МПа в присутствии медноникельхромового катализатора (9% меди, 90% никеля, 1% хрома, носитель - силикагель). Селективность образования бутандиола достигает 98%.
На третьей стадии бутандиол подвергают дегидратации с образованием тетрагидрофурана:
CH2—CH2 CH2OH—CH2—CH2—CH2OH CH2 CH2+ H2O.
CH2 CH2+ H2O.
O
Дегидратация осуществляется в жидкой фазе в присутствии кислого катализатора (фосфорная кислота) при ~533-548 К и 7,0 МПа.
На заключительной стадии проводят дегидратация тетрагидрофурана с образованием бутадиена:
CH2—CH2
CH2 CH2 |
CH2=CH—CH=CH2 + H2O . |
O
127
Процесс проводят при 543-553 К и 0,1 МПа в присутствии в качестве катализатора дигидрофосфата натрия NaН2РО4, нанесенного на кокс или графит.
Метод Реппе в отличие от альдольного способа не получил широкого распространения ввиду сложности технологии.
Синтез бутадиена через димеризацию ацетилена
Этот метод включает димеризацию ацетилена с последующим гидрированием винилацетилена в бутадиен:
2СН СН СН2=СH—C СН,
СН2=СH—C СН,
СН2=СH—C СН + Н2  СН2=СН—СН=СН2.
СН2=СН—СН=СН2.
Метод, несмотря на относительную простоту технологии, не нашел промышленного применения главным образом из-за взрывоопасности реакционных смесей, в состав которых входит ацетилен.
Пиролиз углеводородного сырья
Техническая возможность получения бутадиена пиролизом нефтяных фракций была показана В.Б. Бызовым в России в 1916 г.
При пиролизе любого углеводородного сырья, а особенно легких бензинов, в качестве побочного продукта образуется бутадиен, количество которого зависит от целей и условий проведения процесса. Если целевым продуктом пиролиза является не только этилен, но и пропилен и бутены, то выход бутадиена может достигать 5% (мас.) на пропущенное сырье, а содержание его во фракции С4 может колебаться от 20 до 60% (мас.).
4.1.4.Промышленные способы получения бутадиена из бутана или бутена-1
Производство бутадиена из углеводородов С4 (н-бутан и н-бутены) методами каталитического дегидрирования является основным направлением в современной технологии получения бутадиена. В промышленности используют различные технологические варианты получения бутадиена дегидрированием углеводородов С4. Применяемые процессы можно условно разделить на следующие группы: дегидрирование бутана в бутены, дегидрирование бутенов; одностадийное дегидрирование бутана в бутадиен.
Характерной особенностью реакций дегидрирования с образованием олефинов является ограничение степени превращения условиями равновесия. Реакции дегидрирования всегда являются эндотермическими и, следовательно, равновесие в сторону образования ненасыщенных углеводородов должно сдвигаться с повышением температуры. Степень превращения углеводородов возрастает с повышением температуры и понижением давления. На практике при температурах выше 773-823 К даже в отсутствие катализаторов предельные уг-

128
леводороды претерпевают реакции изомеризации, крекинга и др. Поэтому процесс дегидрирования бутана проводят при температурах до 923-973 К, т.е. при температурах более низких, чем термодинамически оптимальные. Применение катализаторов позволяет достигнуть высокой скорости процесса при относительно низкой температуре, когда еще не существенен вклад побочных реакций. Ввиду обратимости реакций дегидрирования –гидрирования и, следовательно, способности катализаторов ускорять обратимые реакции в обоих направлениях, эти реакции катализируются одними и теми же соединениями.
При дегидрировании вследствие отщепления водорода всегда происходит увеличение объема газа и понижение давления благоприятствует повышению степени конверсии. По этой причине процессы дегидрирования проводят при давлении, близком к атмосферному, а в некоторых случаях процесс осуществляют в вакууме.
Иногда вместо применения вакуума предпочтительнее разбавлять реакционную массу газом, инертным в условиях реакции, или паром, что также приводит к снижению парциальных давлений реагентов и возрастанию равновесной степени конверсии. Снижение парциального давления позволяет также понизить температуру реакции и, следовательно, уменьшить образование побочных продуктов.
Важным параметром при проведении реакции дегидрирования является время контакта реакционной смеси с катализатором. Рис. 4.1 иллюстрирует влияние температуры и времени реакции на содержание бутенов.
Рис. 4.1. Зависимость содержания н-бутенов при каталитическом дегидрировании н-бутана от температуры и времени реакции
Максимальный выход олефинов не соответствует рассчитанной равновесной концентрации при соответствующей температуре: он всегда значительно ниже. С увеличением времени реакции выше оптимального выход олефинов уменьшается, так как увеличивается вклад побочных реакций.
Работы по каталитическому дегидрированию н-бутана по двухстадийному варианту: н-бутан н-бутен бутадиен были начаты в США в 1920-х го-
129
дах. В Советском Союзе фундаментальные исследования в этой области проводили С.В. Лебедев, Н.И. Шуйкин, А.А. Баландин, Б.А. Казанский и др.
Дегидрирование углеводородов С4-С5 в олефины и диены
Дегидрирование бутана в бутен осуществляется в "кипящем слое" алюмохромового катализатора при температуре в реакторе 838-853 К.
Бутены выделяют экстрактивной ректификацией водным ацетоном или диметилформамидом (ДМФА). Бутены дегидрируют в реакторах с неподвижным слоем катализатора и с подводом тепла за счет разбавления исходной смеси водяным паром при 853-893 К на хромкальцийникельфосфатном катализаторе. Общий выход бутадиена - 60% (мас.) от теоретического.
В промышленности США и Западной Европы используется также одностадийный способ дегидрирования бутана до бутадиена по Гудри. По этому способу дегидрированию подвергают бутан-бутеновую смесь в соотношении 60:40 при 873 К и ~1,225 кПа в периодических реакторах с неподвижным слоем алюмохромового катализатора без внешнего теплообмена. Продолжительность процесса 7-10 мин. Регенерацию катализатора проводят выжиганием отложившегося кокса в потоке воздуха. Из продуктов дегидрирования выделяют бутадиен и бутан-бутеновую фракцию, которую направляет далее в рецикл с добавлением в нее свежего бутана. Выход бутадиена составляет до 14% (мас.) на пропущенный и до 54% (мас.) в расчете на превращенный бутан.
Оптимальная глубина дегидрирования н-бутана (~ 30% за проход) достигается при температуре выше 773 К, а для дегидрирования бутенов при атмосферном давлении равновесная глубина превращения даже при температуре 903 К не превышает 30%, что не приемлемо для промышленности. Увеличить выход целевого продукта можно путем снижения парциального давления, например при проведении реакции при 823 К и парциальном давлении 10,1 кПа, что соответствует разбавлению бутена в соотношении 1:10.
Как правило, катализаторы дегидрирования н-бутана состоят из оксида хрома на оксиде алюминия. В качестве промотирующих добавок используют оксиды калия, кремния или бериллия. Общее содержание добавляемых оксидов составляет 1-5%. Промотирующее влияние оказывают также некоторые оксиды лантанидов, например Pr6O11 или Nd2O3. В алюмохромовых катализаторах, по-
лучаемых пропиткой -А12О3 оксид хрома находится в виде -Сr2О3, имеющего корундовую структуру, которая образуется при нагревании СrО3 в присутствии кислорода воздуха.
Окислительное дегидрирование бутана и бутиленов
Отличительная особенность окислительного дегидрирования заключается в том, что равновесие реакции практически полностью смещено вправо. Это

130
позволяет проводить процесс при относительно низких температурах – 753 К. Промышленное значение имеют следующие способы окислительного дегидрирования бутана и изопентана до бутадиена и изопрена: дегидрирование в присутствии иода, кислорода и поглотителей иодида водорода (иодное дегидрирование); каталитическое дегидрирование в присутствии кислорода.
Иодное дегидрирование. Наибольший интерес представляет процесс
иодного дегидрирования н-бутана: |
|
н-C4H10 + 2I2 |
C4H6 + 4HI . |
При этом очень важно создание надежных методов рекуперации (возвращене в технологический цикл в качестве реагента) и рециркуляции иода, стоимость которого в десятки раз превышает стоимость мономеров. Эффективное решение этой задачи состоит в практически необратимом связывании НI в зоне реакции оксидами или гидроксидами щелочных металлов:
2HI + MO  MI2 + H2O,
MI2 + H2O,
2HI + M(OH)2  MI2 + 2H2O.
MI2 + 2H2O.
В качестве поглотителя могут быть использованы оксиды марганца. Регенерация иода осуществляется кислородом:
MI2 + 0,5O2 |
MO + I2, |
MI2 + 0,5O2 + H2O |
M(OH)2 +I2. |
Из побочных реакций следует отметить образование иодидов и крекинг |
|
углеводородов. |
равновесные глубины превращения н- |
При иодном дегидрировании |
|
бутана значительно выше, чем при обычном дегидрировании. Так, при 823 К и одном и том же начальном парциальном давлении ~30,3 кПа (при иодном дегидрировании такое парциальное давление создается при мольном соотношении С4Н10:I2=1:2) равновесные расчетные составы имеют следующие значения:
|
н-С4Н10 |
н-С4Н8 С4Н6 |
|
При обычном дегидрировании, % (мол.) |
28 |
64 |
8 |
При иодном дегидрировании, % (мол.) |
9,5 |
63 |
27,5 |
Таким образом, при иодном дегидрировании, т.е. при связывании водорода в виде HI, равновесные выходы бутадиена существенно увеличиваются по сравнению с выходами при обычном дегидрировании, а равновесные выходы бутенов в обоих случаях сопоставимы. Увеличение соотношения I2:С4Н10 приводит к резкому повышению равновесного выхода бутадиена: при увеличении этого соотношения от 1 до 4 при 823 К выход возрастает с 13 до 77%. Влияние остальных параметров аналогично их влиянию при обычном дегидрировании: равновесные выходы бутадиена увеличиваются с повышением температуры и с уменьшением парциального давления бутана.
