
метода по химии 1 часть
.pdf
11
Изомерия. Для алканов характерна
1. Структурная изомерия: Например,
СН3 |
|
СН2 СН2 |
|
СН3 |
СН3 |
|
СН |
|
СН3 |
|
|
|
|||||||
|
|
|
|
бутан
СН3 изобутан (2–метилпропан)
2. Пространственная (конформационная) изомерия. Этот вид изомерии является результатом свободного вращения вокруг одинарной С-С связи. Геометрические формы молекулы, образующиеся при этом, называются конформациями. Среди множества конформаций этана выделяют экстремальные конформации – наименее (а) и наиболее (б) устойчивые:
H |
H |
H H |
|
|
H |
H |
H |
H |
H |
H |
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
HH |
|
|
|
H |
H |
|
|
|
|
||
|
H |
|
|
H |
H |
|
|
|
|
||
H |
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|
а) заслоненная |
|
б) заторможенная |
|||
Взаслоненной конформации атомы водорода сближены и отталкиваются друг от друга. Это энергетически невыгодно (энергия молекулы максимальна).
Взаторможенной конформации атомы водорода наиболее удалены друг от друга. Это наиболее выгодная конформация (энергия молекулы минимальна).
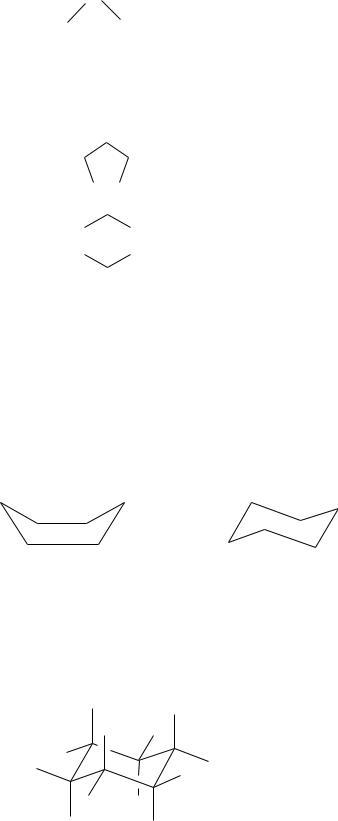
Для 5- и 6-членных углеводородных цепей можно выделить три основные конформации:
а) зигзагообразная |
б) нерегулярная |
в) клешневидная |
Клешневидная конформация дает нам представление о возможности образования 5- и 6-членных циклов. Более длинные углеводородные цепи по данным рентгеноструктурного анализа имеют, в основном, зигзагообразную конформацию.
Химические свойства
Алканы относительно стабильны к таким реагентам как кислоты, щелочи, окислители при обычных условиях. Это объясняется прочностью С-С и С-Н связей.
Алканы подвергаются 2-м типам реакций:

12
1. Реакции замещения.
2.Термические и каталитические реакции.
Эти реакции протекают при повышенных температурах или при поглощении световой энергии через образование высоко реактивных свободных радикалов.
1. Рассмотрим реакцию радикального замещения SR , например, реакцию галогенирования. Она включает несколько этапов.
1-й этап – инициирование. На этом этапе молекула галогена под действием кванта света гомолитически расщепляется на два радикала:
h |
|
|
Br: Br |
Br + Br |
|
гомолиз
2-й этап – рост радикальной цепи. Радикал галогена атакует молекулу алкана. Связь С:Н расщепляется гомолитически с образованием алкильного радикала:
|
|
СН3-СН-СН2-СН3 + Br |
СН3-С-СН2-СН3 + H : Br. |
|
|
CH3 |
CH3 |
Галогенирование алканов обычно приводит к смеси изомеров. Но, в первую очередь, радикальной атаке подвергаются третичные, затем вторичные и в последнюю очередь первичные С-Н- связи:
перв. трет. втор. перв.
СН3 – СН - СН2 - СН3
СН3 перв.
Далее образовавшийся алкил-радикал реагирует с новой молекулой галогена с образованием нового радикала галогена:
|
Br |
|
|
|
. |
СН3-С-СН2-СН3 + Br : Br |
СН3-С-СН2-СН3 +Br |
|
|
|
|
СН3 |
CH3 |
|
Таким образом, развивается радикальная цепь.
3-й этап – обрыв цепи, или рекомбинация радикалов. Он возможен в результате следующих превращений:
а) |
Br + Br |
Br2 |
|
|
|
|
|
б) |
Br + R |
R- Br |
|
|
|
|
|
в) |
R + R |
R – R |
|
Среди галогенпроизводных алканов наиболее физиологически активны хлорпроизводные. Они проявляют наркотическое действие, понижая кровяное давление. В ряду хлорзамещенных метана: СН3Сl – хлористый метил, CH2Cl2 – хлористый метилен, CHCl3 – хлороформ, CCl4 – четыреххлористый углерод – усиливаются наркотическая активность и токсичность.
13
2.Окисление. Алканы вступают в реакции окисления только при очень высокой температуре и в присутствии катализаторов.
Циклоалканы
Это предельные углеводороды циклического строения общей формулы CnH2n
Название |
Структурная формула |
Брутто – формула |
|||||||||||
Циклопропан |
|
|
|
|
CH2 |
С3Н6 |
|||||||
|
CH |
2 |
|
|
|
CH2 |
|
||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Циклобутан |
CH2 |
|
|
|
|
|
|
|
CH2 |
С4H8 |
|||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
||
|
CH |
2 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Циклопентан |
|
|
|
|
|
|
|
|
|
|
|
|
С5Н10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Циклогексан |
|
С6Н12 |
|
|
|
Для циклоалканов, так же как и для алканов, характерна sp3 гибридизация. - Связи должны располагаться под углом 109° друг к другу.
При отклонении угла в цикле от 109° возникает угловое напряжение (теория напряжения циклов Байера).
Особенно неустойчив циклопропан, который легко вступает в реакции присоединения с разрывом кольца. Наиболее устойчивы циклогексан и циклопентан. Они вступают в обычные для алканов реакции SR. Циклобутан занимает промежуточное положение. Для него характерны оба направления реакций.
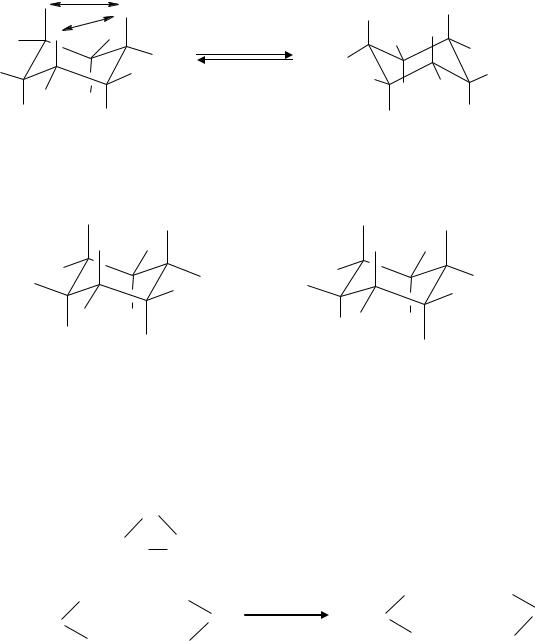
Устойчивость 5- и 6- членных циклов объясняется их неплоским строением. Циклогексан принимает различные конформации, из которых следует выделить две
наиболее устойчивые:
конформация |
конформация |
«ванны» или «лодки» |
«кресла» |
Наиболее выгодной является конформация |
«кресла», так как все углы между |
связями составляют 109°, (т.е. отсутствует угловое напряжение). В конформации «кресла» атомы углерода имеют одну аксиальную (а) и одну экваториальную (е) связи. Аксиальная связь параллельна оси молекулы, а экваториальная – направлена в сторону от кольца.
a
е
14
Для объемного заместителя наименее выгодно аксиальное положение из-за возникающего сильного 1,3-диаксиального взаимодействия, которое приводит к торсионному напряжению и инверсии циклогексанового кольца:
H |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
H |
1 |
инверсия |
4 |
H |
|
2 |
|
|
3 |
|
||||
|
|
|
|
|
|
|
|
|
5 |
|
|
H |
|
6 |
CH3 |
|
|
|
|
|
|||
|
|
|
|
|
5 |
|
1 |
|
|
|
|
|
|
|
|
Поэтому более энергетически выгодно экваториальное расположение |
|||||||
заместителей. |
|
|
|
|
|
|
|
Кроме конформационной изомерии, для циклоалканов характерна геометрическая (цис-транс) изомерия.
CH |
CH3 |
CH |
|
3 |
3 |
CH3
транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
Химические свойства. Химические реакции циклоалканов подобны алканам с открытой цепью, но в зависимости от устойчивости циклов идут в различных направлениях.
Например, галогенирование:
CH2
+ Cl2  Cl-CН2–СН2–СН2–Сl
Cl-CН2–СН2–СН2–Сl
1,3–дихлорпропан
CH2 CH2
|
|
|
|
CH2 |
|
|
CH |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH2 |
|
|
|
+ Cl2, h |
2 |
|
CH-Cl |
|||||||
|
|
CH2 |
CH2 |
|
|
|
|
|||||||
CH2 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
- HCl |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|||
CH2 |
|
|
CH |
2 |
|
CH2 |
|
|
|
|||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
1-хлорциклогексан
Алкены
Алкенами называются углеводороды, содержащие двойную С=С связь, общая формула СnH2n.
|
Название |
Структурная формула |
Брутто-формула |
Этен (этилен) |
СН2 = СН2 |
С2Н4 |
|
Пропен (пропилен) |
СН2=СН-СН3 |
С3Н6 |
|
Бутен-1 |
(бутилен) |
СН2=СН-СН2-СН3 |
С4Н8 |
Бутен-2 |
(псевдобутилен) |
СН3-СН=СН-СН3 |
С4Н8 |

15
Представители этого класса оказывают наркотическое действие; например, 2- метилбутен-2 по свойствам напоминает хлороформ.
Для алкенов характерна структурная (бутен-1 и бутен-2) и пространственная (геометрическая цис/транс) изомерия.
CH3 |
|
|
|
CH3 |
CH3 |
|
|
|
H |
C |
|
|
|
C |
C |
|
|
|
C |
|
|
|
|
|
|||||
|
|
|
|
|
|||||
|
|
|
|||||||
|
|
|
|
|
|
||||
H |
|
|
|
H |
H |
|
|
|
CH3 |
цис-бутен-2 |
транс-бутен-2 |
||||||||
Реакционная способность алкенов определяется наличием двойной связи. Атомы углерода при двойной связи находятся в sp2 гибридизации.
Три sp2 – гибридизованные орбитали лежат в одной плоскости под углом 120° и образуют три прочные - связи. Негибридизованная -орбиталь, перпендикулярная плоскости - связей, участвует в образовании менее прочной и легкополяризуемой - связи.
Строение этилена:
|
H |
H |
H |
C C |
H |
|
||
|
|
|
|
- связь |
- связи |
Химические свойства. Для алкенов наиболее типичны реакции присоединения по месту разрыва -связи. - Cвязь в алкенах богата электронами, поэтому к ней будут притягиваться положительно заряженные йоны или частицы с дефицитом электронов – электрофилы (Е+).
Таким образом, для алкенов характерны реакции электрофильного присоединения
АЕ.
1. Гидрирование |
|
|
|
|
|
Н |
Н |
|
кат. |
|
|
СН3 – СН = СН2 + Н2 |
|
СН3 – СН – СН2 |
|
пропен |
|
пропан |
|
2. Галогенирование
Br Br
СН3 – СН = СН2 + Br2 СН3 – СН – СН2 1,2–дибромпропан
Реакция галогенирования служит для качественного и количественного определения непредельных соединений. Реакция обесцвечивания брома является классической качественной и количественной реакцией на двойную связь.
Например, по количеству поглощенного брома или йода можно установить содержание непредельных высших жирных кислот в составе липидов.
16
3. Гидрогалогенирование: |
|
|
|
|
СН3 –СН=СН2 |
+ |
НСl |
|
СН3 – СН – СН3 |
Cl 2–хлорпропан
Присоединение галогенводородов к несимметричным алкенам происходит в соответствии с правилом Марковникова: водород направляется преимущественно к наиболее гидрогенизированному атому углерода. Обосновать правило Марковникова можно, учитывая два фактора:
1. Статический фактор – распределение электронной плотности в молекуле алкена в исходном состоянии:
+ -
СН3 СН=СН2
Положительный индуктивный эффект СН3 – группы приводит к поляризации - связи и атаке электрофила Н+ первого атома углерода.
2. Динамический фактор – оценка относительной устойчивости возникающих промежуточных частиц:
|
|
|
|
|
+ |
|
|
|
|
атака С1 |
СН3 СН СН3 |
3 |
2 |
1 |
|
|
(I) |
|
|
||||
|
|
|
|||
СН3 – СН = СН2 + Н+ |
|
атака С2 |
+ |
||
|
|||||
|
|
|
|
||
|
|
|
|
|
СН3 СН2 СН2 |
|
|
|
|
|
|
|
|
|
|
|
(II) |
Карбкатион (I) более стабилен, так как положительный заряд стабилизируется +I – эффектами двух алкильных (метильных) групп. Карбкатион (II) менее стабилен за счет +I– эффекта только одной алкильной (этильной) группы.
Реакция протекает с предпочтительным образованием наиболее устойчивого карбкатиона (I):
|
|
|
|
Сl |
|
+ |
|
+Cl- |
|
СН3-СН =СН2 + Н+ СН3-СН-СН3 |
|
СН3 – СН-СН3 |
||
4. Гидратация: |
|
|
|
|
|
|
|
|
ОН |
+ |
- |
Н+ |
|
|
CH3 С = СН2 + Н2О |
|
|
СН3 – С- СН3 |
|
|
|
|
|
|
СН3 |
|
|
|
СН3 |
2 – метилпропен |
|
|
2–метилпропанол–2 |
|
Реакция протекает также в соответствии с правилом Марковникова.

17
5. Окисление (по Вагнеру). При окислении алкенов разбавленными растворами перманганата калия в нейтральной или слабощелочной среде получаются двухатомные спирты (гликоли):
3 СН2 = СН2 + 2 КMnO4 + 4H2O |
3 CH2 –CH2 + 2KOH + 2MnO2 |
|
этилен |
|
|
OH OH
этиленгликоль
Реакция используется как качественная для обнаружения двойной связи (по обесцвечиванию раствора KMnO4).
6. Полимеризация:
|
|
|
|
|
|
|
|
n C |
|
|
|
C |
( С С ) n |
||
|
|
|
|
|
|||
|
|
|
|||||
|
|
|
|
|
|||
мономер |
полимер |
||||||
n CH3 - CH = CH2 |
( - |
CH - CH2 - ) n |
|||||
|
|
|
|
|
CH3 |
|
|
пропилен |
полипропилен |
||||||
Алкадиены
Это углеводороды, содержащие две двойные связи. Общая формула Сn H2n-2.
Наибольший интерес представляют сопряженные алкадиены – соединения с чередующимися двойными и одинарными связями.
Название |
Структурная формула |
Брутто– формула |
Бутадиен (дивинил) |
СН2 = СН – СН = СН2 |
С4Н6 |
2–Метилбутадиен–1,3 |
СН2 = С– СН=СН2 |
С5Н8 |
(изопрен) |
|
|
СН3
Химические свойства
Для алкадиенов наиболее характерны реакции АЕ, так же как и для алкенов, но проявляются особенности, связанные с сопряжением Присоединение 1 молекулы реагента возможно в разные положения: 1,2; 3,4 и 1,4.
1. Гидрирование:
1,2 – присоединение
СН3–СН2–СН=СН2
кат.
СН2 = СН – СН = СН2 + Н2
1,4 – присоединение
 СН3–СН=СН-СН3
СН3–СН=СН-СН3

18
2. Гидрогалогенирование: |
|
|
|
|||||
|
|
|
|
|
|
|
|
Сl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,2 – присоединение |
|
СН3-С-СН=СН2 |
|
|
|
|
|
|
|
|
|
1 |
2 3 |
4 |
|
|
|
|
|
СН3 |
СН2=С-СН = СН2 + HСl |
|
|
|
|
Сl |
|||
|
|
|
||||||
|
|
|
|
|
|
3,4 – присоединение |
|
|
|
СН3 |
|
|
|
|
|
|
СН2=С-СН-СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
|
|
|
1,4- присоединение |
|
|
|
|
|
|
|
|
|
Н3С-С=СН-СН2-Сl |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
3. Полимеризация идет аналогично присоединению: |
||||||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
1,2- |
|
|
|
|
|
|
|
|
|
СН2 – С n |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH=CH2 |
1 |
2 3 |
4 |
|
|
|
3,4- |
|
|
nСН2=С-СН=СН2 |
|
|
|
|
|
|||
|
|
|
|
|||||
|
|
|
|
|
|
|
CH-CH2 n |
|
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3-C =CH2 |
||
|
|
|
|
|
|
1,4- |
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
-- CH2 - C = CH - CH2 - |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
Кроме природного каучука, который, как известно, является 1,4-полимером изопрена, существует большая группа веществ (углеводородов и их производных), которые можно разделить на n скелетных фрагментов изопрена. Они называются
терпенами.
Ароматические углеводороды (арены)
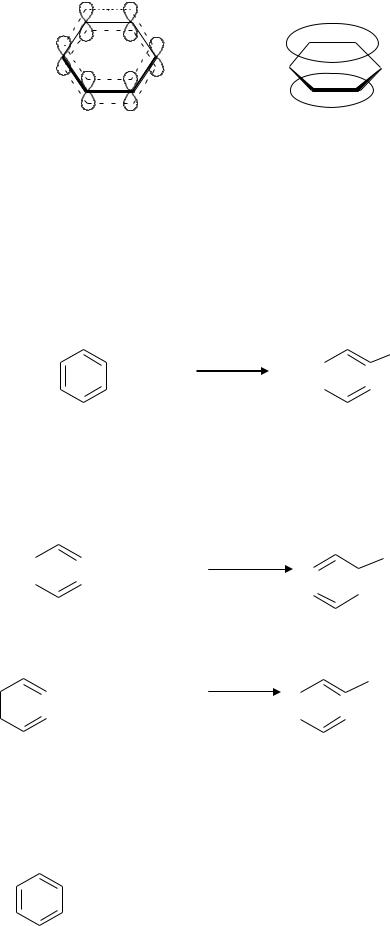
Простейшим представителем аренов является бензол:
Для бензола и его гомологов выполняются следующие 3 главных критерия ароматичности:
1. Все атомы углерода находятся в sp2 – гибридизации. Следовательно, - остов молекулы плоский, циклический.
19
2.Число р-электронов соответствует правилу Хюккеля (4n+2). Правило Хюккеля выполняется при любом натуральном числе n = 0, 1, 2 и т.д. В данном случае в бензоле 6 электронов (n =1)
3.Единая, замкнутая, сопряженная - система охватывает все атомы цикла.
Химические свойства
Ароматические соединения обладают рядом специфических свойств.
1.Высокая термодинамическая устойчивость.
2.Устойчивость к действию окислителей.
3.Реакции электрофильного замещения (SE).
Реакции электрофильного замещения
1. Галогенирование:
FeCl3
Cl
+ Cl2 |
|
|
+ HCl |
|
|
||
|
|
|
|
хлорбензол
Роль катализатора (FeCl3, ZnCl2, AlCl3) заключается в поляризации молекулы галогена и выделении электрофила Cl+
+ClCl -…. FeCl3  Cl+ + FeCl-4
Cl+ + FeCl-4
2. |
Нитрование: |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
NO2 + H2O |
|
|
|
|
|
|
+ - HO +NO2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нитробензол |
|
||||||
3. |
Сульфирование: |
|
|
|
|
|
|
|
|
|
||||
|
- |
+ |
|
|
|
|
|
|
|
SO3H |
|
|||
|
|
+ |
HOSO3H |
|
|
|
|
|
|
|
|
+ H2O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензолсульфокислота
4. Алкилирование:

20
+ |
- ZnCl2 |
|
|
CH3 |
+ СH3 Cl |
|
|
+ HCl |
|
|
|
|
|
|
толуол (метилбензол)
Введение алкильных групп (метильной, изопропильной) усиливает токсическое действие бензола. Гомологи бензола и его производные также вступают в реакции SE, но с разной скоростью. Скорость реакции и ориентация входящего в кольцо заместителя (электрофила) зависят от влияния уже имеющихся заместителей.
Заместители I рода (NH2, OH, OCH3 и др.) – электронодоноры, увеличивают электронную плотность в кольце, облегчают реакцию SE и ориентируют входящий электрофил в орто- и пара-положения.
Названия приставок для дизамещенных производных бензола.
X
|
|
|
орто |
орто |
|
|
|
|
мета |
мета |
|
|
|
|
|
пара |
|
|
:NH2 |
|
|
NH2 |
NH2 |
|
|
|
|
||
|
|
|
|
ZnCl2 |
CH3 |
2 |
+ 2 |
CH3-Cl |
|
+ |
|
|
- 2 HCl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
Заместители 2 рода ( -COOH, -SO3H, -CHO, -NO2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию SE и ориентируют электрофил в мета-положение.
H |
O |
|
|
H |
O |
C |
|
|
|
|
C |
|
|
+ |
ZnCl2 |
|
|
|
|
Cl2 |
|
|
|
|
- HCl |
|
Cl |
||
|
|
|
|
||
бензальдегид |
|
|
м-хлорбензальдегид |
||
-M, -I |
(Э.А) |
|
|
|
|
5. Окисление аренов. Бензол устойчив к действию окислителей, но его гомологи, содержащие алифатический радикал, легко окисляются до бензойной кислоты:
