Узнавание субстратов убиквитин-лигазами
Существуют три принципиальных пути узнавания субстратов убиквитин-лигазами:
1. Узнавание определённого мотива, конститутивно входящего в состав белка. Например, узнаётся определённый N-концевой аминокислотный остаток (так называемое N-правило). Однако присутствие мотива, узнаваемого Е3 (дегрона) в структуре белка не говорит о том, что этот белок обязан деградировать. Обычно дегрон располагается в непосредственной близости от последовательности, ответственной за взаимодействие с субстратом или шапероном, сайта олигомеризации (в случае, если белок активен в виде олигомера), бывает спрятан соответствующей нативной структурой. Таким образом, если белок правильно свёрнут и функционально востребован, дегрон будет пространственно не доступен, Е3 не сможет с ним связаться, деградации не произойдёт.
2. Узнавание белка, подвергшегося определённой модификации.
Пример: Для активации транскрипционного фактора NF kappa B необходимо фос-форилирование соответствующего ингибитора (I kappa B). I kappa B, образуя комплекс с NF kappa B, маскирует сигнал ядерной локализации, принадлежащий фактору – фактор не может попасть в ядро. Фосфорилированная форма I kappa B узнается соответствующим Е3 и немедленно подвергается протеолизу. В результате NF kappa B высвобождается, перемещается в ядро, принимает участие в регуляции транскрипции.
-
Узнавание субстрата в комплексе с соответствующим адапторным белоком.
Пример: Вирус папилломы человека (HPV) кодирует белок E6 и белок, ассоциированный с Е6 (E6-AP). Комплекс Е6 и E6-AP узнаётся убиквитин-лигазой, ответственной за его деградацию.
|
|
|
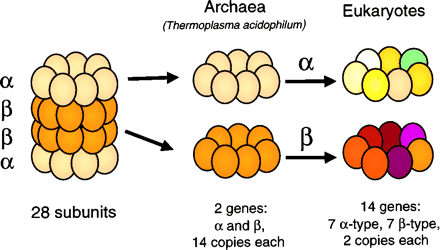
Рис. 1. Каталитический комплекс протеосомы архей и эукариот. |
Протеосома
26S протеосома состоит из сердцевинного каталитического комплекса 20S, ланкированного с двух сторон регуляторными субъединицами 19S. Молекулярная масса 26S протеосомы – 2МДа. За рядом исключений 26S протеосома узнаёт и подвергает протеолизу полиубиквитинированные белки. 20S комплекс построен из четырёх колец: (рис. 1). Каждое из колец состоит из семи субединиц. Эти субъединицы кодируются 14 генами: семь кодируют разные -, семь – разные -субъединицы. В -кольцах локализованы три каталитических сайта: сайт, похожий на трипсин (узнаёт остатки тирозина и фенилиаланина), сайт, похожий на химотрипсин (узнаёт остатки лизина и аргинина) и сайт, производящий гидролиз полипептидной цепи после остатка глутамата. Каждый сайт построен из двух, одинаковых -субъединиц, входящих в состав разных колец.
-кольца необходимы для стабилизации -колец, а также для связывания 20S субъединицы с 19S кэпирующими комплексами. 19S кэпирующая субъединица состоит из 2-х частей: основания и крышки. Основание отвечает за связывание с 20S и обладает АТФазной активностью. Крышка отвечает за узнавание полиубиквитинированных белков-субстратов.
Деградация белков, ассоциированных с мембраной
Процессирование белков, ассоциированных с мембраной, отличается от деградации цитоплазматических белков. Основные отличия данного процесса:
1. Деградация осуществляется лизосомами.
2. Для таргетинга белка в лизосомы обычно достаточно моноубиквитинирования. В некоторых случаях формируется полиубиквитиновая цепь.
3. В случае формирования полиубиквитиновой цепи связывание происходит по 63 лизину.
Выщепление убиквитина из аддуктов – процесс, обратный убиквитинированию
В определённых ситуациях клетке необходимо выщеплять убиквитин из образуемых им аддуктов. Например: необходимо отщеплять убиквитин от продуктов протеолиза, от белков, к которым он присоединился по ошибке. Кроме того, убиквитин синтезируется в виде линейного полипредшественника – необходимо нарезать из него функциональные молекулы. При этом на C-конеце последнего мономера полипредшественника закодирован дополнительный аминокислотный остаток, который необходимо отщепить, так как он блокирует активный глицин. Есть два рибосомальных белка, на N-конце которых закодирован убиквитин. Таким образом, обеспечивается таргетинг этих белков к рибосоме. После того, как вышеупомянутые белки включились в рибосомальный комплекс, убиквитин необходимо отщепить. Белки, осуществляющие выщепление убиквитина, относятся к тиоловым протеиназам и узнают С-концевой аминокислотный остаток молекулы убиквитина.