
Методичка з Фіз.хімії з Лр
..pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ “ЛЬВІВСЬКА ПОЛІТЕХНІКА”
ЛАБОРАТОРНИЙ ПРАКТИКУМ
З курсу «Фізична та колоїдна хімія, ч.2» для студентів базового напрямку 1102 «Фармація»
(зі змінами від 12.01.2012 та 12.02.2014)
Затверджено на засіданні кафедри фізичної та колоїдної хімії
Протокол № 12 від 10 травня 2006 р.
Львів – 2006
Лабораторний практикум з курсів „Поверхневі явища та дисперсні системи” та „Фізична хімія дисперсних систем та полімерів” для студентів базових напрямків 0916 „Хімічна технологія та інженерія” та 1102 „Фармація”/ Укл.: Ван-Чин-Сян Ю.Я., Сергеєв В.В., Герасимчук С.І., Павловський Ю.П.– Львів: Видавництво Національного університету “Львівська політехніка”, 2006.
– 40 с.
Укладачі |
Ван-Чин-Сян Ю. Я., д-р хім. наук, професор; |
|
Сергеєв В. В., канд. хім. наук, доцент; |
|
Павловський Ю. П., канд. хім. наук, доцент; |
|
Герасимчук С. І., канд. хім. наук, доцент. |
Відповідальний за випуск Ван-Чин-Сян Ю.Я., д-р хім. наук, професор
Рецензент |
Реутський В.В. д-р.техн.наук, професор |
2
ВСТУП
Внаціональному університеті „Львівська політехніка” лабораторні роботи
зколоїдної хімії виконуються студентами базових напрямків „Хімічна технологія та інженерія”, „Фармація”, „Біотехнологія”, „Харчова інженерія” та „Екологія” в курсах „Поверхневі явища та дисперсні системи”, „Фізична хімія дисперсних систем та полімерів” та „Фізична та колоїдна хімія”.
Даний практикум складений на основі літературних даних та досвіду набутого в результаті постановки лабораторних робіт викладачами кафедри фізичної та колоїдної хімії. Посібник крім опису лабораторних робіт, містить теоретичні відомості та контрольні питання до кожної лабораторної роботи.
При підготовці до виконання лабораторної роботи студент повинен вивчити теоретичні відомості та оформити звіт який має включати: титульну сторінку, назву та мету роботи, конспект теоретичного матеріалу до конкретної роботи або відповіді на контрольні питання, опис експериментальної частини та бланк протоколу досліду.
Після виконання роботи у протоколі досліду слід зазначити дату виконання експерименту, використані реактиви, прилади та лабораторне обладнання. Отримані експериментальні дані та результати розрахунків слід занести у відповідні таблиці. У протоколі також мають бути необхідні до даної роботи розрахунки та виконані на міліметровому папері графіки.
3
ОДЕРЖАННЯ ТА ОЧИСТКА ДИСПЕРСНИХ СИСТЕМ. ЕЛЕКТРОКІНЕТИЧНІ ЯВИЩА. КОАГУЛЯЦІЯ.
Методи одержання дисперсних систем.
Дисперсними називають гетерогенні системи, в яких одна із фаз знаходиться в подрібненому стані. Фазу, яка складається із частинок подрібненої речовини, називають дисперсною фазою, а середовище, в якому розподілені ці частинки - дисперсійним середовищем. В залежності від розміру частинок подрібненої фази дисперсні системи поділяють на
-ультрамікрогетерогенні або колоїдні, розмір частинок від 10-9 до 10-7м,
-мікрогетерогенні, розмір частинок від 10-7 до 10-5м;
-грубодисперсні , з частинками , розмір яких є більшим від 10-5 м. Дисперсні системи з частинками колоїдних розмірів прийнято називати
золями. Такі системи є основним об’єктом вивчення колоїдної хімії. Вони характеризуються розвиненою міжфазною поверхнею і великим запасом вільної поверхневої енергії. Колоїдні системи є термодинамічно нестійкими і виявляють високу здатність до агрегації (укрупнення частинок). Оскільки частинки золів близькі за розмірами до молекул вони мають здатність приймати участь у тепловому русі. При зіткненні, під дією міжмолекулярних сил притягання, частинки злипаються, утворюючи більш крупні частинки дисперсної фази, які осідають під дією гравітаційного поля.
За розміром частинок золі займають проміжне місце між істинними розчинами та грубодисперсними системами і їх можна отримати двома принципово різними методами
-диспергаційним, який полягає у подрібненні крупних частинок дисперсної фази до колоїдних розмірів.
-конденсаційним (агрегаційним), в процесі якого окремі молекули, іони або атоми об’єднуються в більш крупні агрегати.
Золі можна одержати диспергаційним методом а) механічним подрібненням частинок грубих дисперсій б) ультразвуковим диспергуванням в) електричним диспергуванням у вольтовій дузі.
Особливим випадком одержання золів є отримання їх із гелів або пухких осадів, що утворюються при коагуляції. Цей метод називається пептизацією. Пептизацію осаду проводять шляхом промивання його водою і виділенням із нього електроліту, який викликав коагуляцію дисперсної системи.
Одержання золів агрегаційним методом здійснюється
4
а) шляхом конденсації переохолодженої пари в повітряному або рідкому середовищі;
б) зміною складу середовища (розчинника) або умов існування системи таким чином, щоб розчинена речовина в нових умовах стала нерозчинною;
в) проведенням хімічних реакцій з утворенням нерозчинної в даному середовищі речовини.
Прикладом отримання золів агрегацій ним методом є конденсація переохолодженої пари в повітряному середовищі. При переохолодженні пари речовини в системі створюється надлишковий тиск (перенасичення), величина якого є більшою від рівноважного тиску. Внаслідок цього в газовій фазі утворюються крупні агрегати молекул у вигляді краплинок рідини (туман) або твердих частинок (дим). При пропусканні пари речовини через охолоджену рідину отримують ліозолі. Таким методом одержують колоїдні розчини сірки, селену, телуру, ртуті.
Метод заміни розчинника полягає в тому, що для одержання золю речовину попередньо розчиняють у рідині, з якою вона утворює істинний розчин. Цей розчин переливають у великий об’єм іншого розчинника, який необмежено розчиняється в першому, але не розчиняє дану речовину. Метод заміни розчинника використовують при одержанні золів смол, каніфолі, колодію.
Агрегаційний метод отримання колоїдних систем також може бути застосований шляхом проведення хімічних реакцій, якщо в результаті реакції утворюється нерозчинна в даному середовищі речовина. Колоїдні системи одержують при протіканні реакцій всіх типів обміну, відновлення, окислення, гідролізу, полімеризації.
Будова міцели.
Сольватовані частинки дисперсної фази золя називають міцелами.
Міцели ліофільних золів це асоціати із десятків – сотень дифільних молекул які мають достатньо розвинуті гідрофобні і полярні гідрофільні групи. В таких міцелах, які як правило утворюють поверхнево-активні речовини ліофобні частини молекул з’єднуються одна з одною утворюючи ядро міцели, а ліофільні групи молекул спрямовані в бік розчинника і утворюють зовнішній шар.
Міцели ліофобних золів складаються з ядра (мікрокристал), оточеного адсорбційно-сольватним шаром молекул дисперсійного середовища і стабілізатора. В гідрозолях стабілізованих електролітами, адсорбційносольватний шар – подвійний електричний шар. Частинки дисперсної фази
5

ліофобного золю мають складну структуру, що залежить від умов одержання золів.
Припустимо, що золь йодиду срібла утворюється за реакцією:
AgNO3 + KI = AgI↓ + KNO3
При цьому основу колоїдної частинки складають мікрокристали важкорозчинної солі AgI, що містять т молекул AgІ . Ці мікрокристали називаються агрегатом. Поверхня агрегату в даному випадку є тією поверхнею, на якій виникає ПЕШ. Вона активна і адсорбує іони електроліту, що знаходяться у дисперсійному середовищі.
Адсорбція відбувається згідно з правилом Паннета - Фаянса: вибірково адсорбуються іони, які здатні прийняти участь у добудові кристалічних ґраток твердої фази.
Рис. 1. Схема будови та формула міцели золю AgI в розведеному розчині KI.
Якщо реакція відбуватиметься в надлишку КІ, то на поверхні агрегату адсорбується шар потенціалвизначальних іонів - негативно заряджених іонів йоду І-. Агрегат разом з потенціал визначальними іонами є частинкою твердої фази і її називають ядром. Під дією електростатичних сил до ядра будуть притягуватися проти іони - іони калію К+, які компенсують заряд ядра. Частина протиіонів (п-х) міцно утримується біля ядра і утворює адсорбційний шар протиіонів. Ядро разом з протиіонами адсорбційного шару називається
6
колоїдною частинкою, або гранулою. Решта протиіонів, які слабше зв’язані з ядром, утворюють дифузійний шар. Таке утворення називається міцелою (Рис.1.). Числа т, п та х можуть змінюватися в широких межах залежно від умов одержання.
Міцели золів завжди електронейтральні. Структуру міцели ліофобного золю можна показати схематично або записати формулою.
Методи очистки дисперсних систем.
При одержанні колоїдних розчинів тим чи іншим способом, особливо за допомогою хімічних реакцій, практично неможливо точно підібрати необхідне кількісне співвідношення реагентів. Тому в золях може бути надлишок електролітів, що знижує стійкість колоїдних розчинів. Для одержання високостійких систем золі очищають як від електролітів, так і від інших низькомолекулярних домішок. Очистку колоїдних розчинів проводять методом діалізу або ультрафільтрацією.
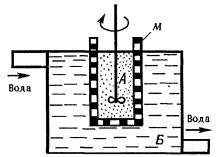
Діаліз полягає у вилученні із золів низькомолекулярних речовин чистим розчинником за допомогою напівпроникної плівки (мембрани), через яку не проходять колоїдні частинки. Замінюючи розчинник у приладі для діалізу – діалізаторі (Рис.2.), можна практично повністю вилучити з колоїдного розчину домішки електролітів та низькомолекулярних неелектролітів.
Рис. 2. Схема діалізатора: А - колоїдний розчин; Б - розчинник(вода); М – мембрана
Принцип діалізу був використаний при створенні апарату, названого «штучною ниркою». За допомогою «штучної нирки» можна очищати кров від продуктів обміну речовин, тимчасово замінюючи функцію хворої нирки.
Електродіаліз - це процес діалізу, який проводять в постійному електричному полі. Електродіалізатор (Рис.3.) - це ємність, розділена мембранами на три камери. Середню камеру заповнюють колоїдним розчином, з якого необхідно видалити домішки. В бокові камери занурюють електроди, до яких підводять постійний електричний струм та забезпечують підведення та виведення розчинника (води). Під дією електричного поля відбувається
7

перенос катіонів із середньої камери в катодну, а аніонів - в анодну. Таким чином розчин в середній камері можна очистити від домішок за короткий проміжок часу.
Рис. 3. Схема електродіалізатора: А - колоїдний розчин; Б - розчинник (вода); М
– мембрана
Ультрафільтрація - це фільтрування колоїдних розчинів крізь напівпроникну мембрану, яка пропускає дисперсійне середовище з низькомолекулярними домішками і затримує частинки дисперсної фази або макромолекули. Для прискорення процесу ультрафільтрації його проводять з перепадом тисків по обидва боки мембрани: при розрідженні (вакуумі) або підвищеному тиску. Для запобігання руйнування мембрани її кладуть на тверду пористу поверхню (Рис.4.).
Ультрафільтрацією можна швидше відділити від колоїдного розчину електроліти та інші домішки (низькомолекулярні органічні сполуки), ніж при діалізі.
Рис. 4. Схема приладу для ультрафільтрації:
А - колоїдний розчин; В - лійка; М - мембрана; П - перфорована пластина; У – ультрафільтрат
Електрокінетичні явища.
8
Електрокінетичні явища спостерігаються в дисперсних системах при дії на них зовнішнього електричного поля. Направлене переміщення частинок дисперсної фази в електричному полі називається електрофорезом, а дисперсійного середовища в пористих тілах електроосмосом.
Електрокінетичні явища в дисперсних системах зумовлені існуванням на межі поділу між дисперсною фазою (твердою частиною) і дисперсним середовищем подвійного електричного шару (ПЕШ), до складу якого входять іони протилежних знаків.
В ПЕШ іони одного знаку міцно зв’язані з поверхнею частинки силами вибіркової адсорбції і називаються потенціалвизначаючими. Ці іони зумовлюють виникнення потенціалу 0 на поверхні твердої частинки, який називають потенціалом поверхні.
Частина іонів протилежного знаку (протиіонів) під впливом електростатичних та адсорбційних сил утримується на дуже близькій відстані від поверхні частинки і разом з потенціалвизначаючими іонами утворює адсорбційний шар, товщиною . Цей шар являє собою плоский конденсатор. Потенціал в адсорбційному шарі спадає лінійно. Решта протиіонів необхідних для компенсації заряду поверхні в результаті теплового руху розподілені в дисперсійному середовищі навколо поверхні і утворюють дифузійну частину подвійного електричного шару та зв’язані з поверхнею частинки лише електростатичними силами притягання. В дифузійному шарі спостерігається поступове падіння потенціалу за експоненційною залежністю.
При дії на частинку зовнішнього електричного поля подвійний електричний шар розривається по площині ковзання, яка проходить в області дифузійного шару.
В результаті розриву ПЕШ частина протиіонів залишається в дисперсійному середовищі. Дисперсна фаза і дисперсне середовище набувають заряди протилежних знаків, а на межі розриву виникає потенціал, який називають (дзета)-потенціалом, або електрокінетичним потенціалом. Цей потенціал зумовлює рух частинки в зовнішньому електричному полі.
На рис.5 зображена схема ПЕШ і падіння в ньому електричного потенціалу. Площина ковзання показана пунктирною лінією. Відстань, на якій цей потенціал поверхні зменшується в е раз , називають товщиною дифузійного шару і позначають .
9

Рис. 5. Падіння потенціалу в подвійному електричному шарі.
Для визначення -потенціалу розглянемо електрофорез твердої сферичної частинки, яка не проводить електричний струм і знаходиться в розбавленому розчині електроліту.
Залежність швидкості руху частинки дисперсної фази в зовнішньому
електричному полі описується рівнянням Гельмгольца-Смолуховськго: |
|
uo = oH/ |
(1) |
- електрокінетичний потенціал; |
|
- відносна діелектрична проникність середовища; |
|
- в’язкість середовища |
|
o - діелектрична проникність вакууму, рівна 8,85 10-12Ф/м |
|
Н- напруженість електричного поля . |
|
H = E/L |
(2) |
E - різниця потенціалів
L - відстань між електродами.
Швидкість руху частинки знаходять, вимірюючи шлях S, пройдений нею за час .
|
|
|
|
|
|
uo = S/ |
|
|
|
|
( 3) |
|||
В залежності від форми частинки в рівняння (1) може вводитись |
||||||||||||||
поправка від 1 до 2/3, яка враховує електрофоретичне гальмування. |
|
|||||||||||||
Електрокінетичний потенціал частинок розраховують за рівнянням |
|
|||||||||||||
|
|
|
u0 |
|
|
|
або |
|
|
|
uеф |
( 4), |
||
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||
0 |
H |
|
0 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
Відношення uo/H називають електрофоретичною рухомістю і позначають |
||||||||||||||
uеф. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
u |
|
|
u0 |
|
S L |
|
|
|
|
( 5 ) |
|
|
|
|
еф |
|
|
|
|
|
|
||||
|
|
|
|
|
|
H |
E |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
