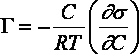Вопрос 57
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами. Поверхностные явления изучаются коллоидной химией.
Равнодействующая сил, действующих на все молекулы, находящиеся на границе свободной поверхности, и есть сила поверхностного натяжения. В целом она действует так, что стремится сократить поверхность жидкости.
![]() .
.
Согласно этой формуле единицей коэффициента поверхностного натяжения в СИ является ньютон на метр (Н/м).
Коэффициент поверхностного натяжения σ численно равен силе поверхностного натяжения, действующей на единицу длины границы свободной поверхности жидкости. Коэффициент поверхностного натяжения зависит от природы жидкости, от температуры и от наличия примесей. При увеличении температуры он уменьшается.
Поверхностная энергия
Молекулы поверхностного слоя жидкости обладают дополнительной потенциальной энергией по сравнению с молекулами внутри жидкости. Эту энергию называют поверхностной энергией. Величина поверхностной энергии тем больше, чем больше площадь свободной поверхности
![]() .
.
Единицей коэффициента поверхностного натяжения в СИ является джоуль на квадратный метр (Дж/м2)
Поверхностное натяжение-σ есть величина измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя. Оно численно равно работе ,которую необходимо совершить для образования единицы поверхности раздела фаз при постоянной температуре.
Количественной мерой адсорбции на границе раствор-пар является поверхностный избыток Г (гамма), равный числу молей растворенного вещества в поверхностном слое. Количественное соотношение между адсорбцией (поверхностным избытком) растворенного вещества и изменением поверхностного натяжения раствора с ростом концентрации раствора определяет изотерма адсорбции Гиббса:
![]() (IV.5)
(IV.5)
График изотермы адсорбции ПАВ представлен на рис. 4.2. Из уравнения (IV.5) следует, что направление процесса – концентрирование вещества в поверхностном слое или, наоборот, нахождение его в объеме жидкой фазы – определяется знаком производной dσ/dС. Отрицательная величина данной производной соответствует накоплению вещества в поверхностном слое (Г > 0), положительная – меньшей концентрации вещества в поверхностном слое по сравнению с его концентрацией в объеме раствора.
Величину g = –dσ/dС называют также поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации С1 определяют графически, проводя касательную к изотерме поверхностного натяжения в точке С = С1; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:
![]() (IV.6
(IV.6
Сорбция представляет собой сложный физико-химический процесс ,который можно рассматривать ,как сумму более простых процессов –адсорбции,абсорбции и капиллярной конденсации. Поглотитель принято называть- сорбентом, а поглощенное вещество – сорбтивом или сорбатом.
Вопрос 58 Все вещества по их воздействию на поверхностное натяжение воды можно разделить на три группы (рис.4): 1. ^ Поверхностно-активные вещества (ПАВ) - понижают поверхностное натяжение растворителя (sр.р<s0), g>0 (по отношению к воде - органические соединения дифильного строения - органические кислоты, спирты, амины, эфиры и т.д). 2. ^ Поверхностно-инактивные вещества (ПИВ) - незначительно повышают поверхностное натяжение растворителя (sр.р >s0), g<0 (неорганические кислоты, основания, соли, глицерин, a-аминокислоты и др). 3. ^ Поверхностно-неактивные вещества (ПНВ) - практически не изменяют поверхностного натяжения растворителя (sр.р =s0), g=0 (по отношению к воде веществами являются сахароза и ряд других).</s
^ Рис.4. Изотермы
поверхностного натяжения и
адсорбции
растворов ПАВ (3), ПНВ (2) и ПИВ (1)
Правило
Дюкло – Траубе:
в любом гомологическом ряду при малых
концентрациях удлинение углеродной
цепи на одну группу СН2 увеличивает
поверхностную активность в 3 – 3,5
раза:
![]() (3.4)
(3.4)
Понятие об адсорбции
АДСОРБЦИЯ (от лат. ad-на, при и sorbeo-поглощаю), изменение (обычно-повышение) концентрации в-ва вблизи пов-сти раздела фаз ("поглощение на пов-сти"). В общем случае причина адсорбции - нескомпенсированность межмол. сил вблизи этой пов-сти, т.е. наличие адсорбц. силового поля. Тело, создающее такое поле, наз. адсорбентом, в-во, молекулы к-рого могут адсорбироваться,-а д с о р б т и в о м, уже адсорбиров. в-во-адсорбатом. Процесс, обратный адсорбции, наз. десорбцией.
Природа адсорбц. сил м. б. весьма различной. Если это ван-дер-ваальсовы силы, то адсорбция наз. физической, если валентные (т.е. адсорбция сопровождается образованием поверхностных хим. соединений), - химической, или хемосорбцией. Отличит. черты хемосорбции - необратимость, высокие тепловые эффекты (сотни кДж/моль), активированный характер. Между физ. и хим. адсорбцией существует множество промежут. случаев (напр., адсорбция, обусловленная образованием водородных связей). Возможны также разл. типы физ. адсорбции наиб. универсально проявление дисперсионных межмол. сил притяжения, т. к. они приблизительно постоянны для адсорбентов с пов-стью любой хим. природы (т. наз. неспецифич. адсорбция). Физ. адсорбция может быть вызвана электростатич. силами (взаимод. между ионами, диполями или квадруполями); при этом адсорбция определяется хим. природой молекул адсорбтива (т. наз. специфич. адсорбция). Значит. роль при адсорбции играет также геометрия пов-сти раздела: в случае плоской пов-сти говорят об адсорбции на открытой пов-сти, в случае слабо или сильно искривленной пов-сти-об адсорбции в порах адсорбента. Адсорбция может происходить на любой пов-сти раздела между двумя любыми фазами, в частности на пов-сти раздела флюид-флюид (жидкость - газ, жидкость - жидкость) или твердое тело-флюид (твердое - газ, твердое-жидкость).
Адсорбция на границе жид-кость – газ, жидкость – жидкость.
Атомы или молекулы конденсированных фаз (жидкостей и твердых тел), находящиеся на поверхности, обладают большей энергией по сравнению с таковыми в объеме фаз. Поскольку эти частицы на поверхности связаны с меньшим числом соседних атомов или молекул, чем в объеме фазы, то переход частицы (молекулы или атома) из объема фазы на поверхность связан с разрывом некоторых связей. Поэтому увеличение числа молекул или атомов на поверхности, то есть увеличение поверхности требует затраты энергии, которая идет на разрыв существующих межмолекулярных связей и превращается в свободную поверхностную энергию атомов или молекул. работа, необходимая для создания единицы новой поверхности или эквивалентная ей свободная энергия единицы поверхности называется поверхностным натяжением. Оно обозначается буквой σ и измеряется в Дж/м2.
Обратный процесс уменьшения поверхности будет протекать самопроизвольно, поскольку по второму закону термодинамики сопровождается уменьшением энергии Гиббса системы. Именно этим (наименьшая поверхность при данном объеме) объясняется сферическая форма жидкостей в условиях невесомости.
Поверхностное натяжение жидкостей зависит от температуры и наличия примесей С ростом температуры поверхностное натяжение линейно падает. Вблизи Т (критическая температура) линейный ход нарушается, а поверхностное натяжение становится равным нулю. Все вещества, по своему влиянию на поверхностное натяжение, делятся на два типа: 1. Вещества, способные повышать поверхностное натяжение жидкостей, называются поверхностно-инактивными (ПиАВ). Для воды, например, таковыми являются электролиты. 2. Вещества, понижающие поверхностное натяжение жидкостей, называются поверхностно-активными веществами (ПАВ).
Молекула ПАВ имеет характерное строение. Она обязательно состоит из двух частей: 1) неполярный радикал (алифатический, ароматический или их сочетание); 2) полярная группа (ОН,NН2, СООН, ОSО3Н).
Поскольку полярные группы имеют большое сродство к полярным, а неполярные радикалы – к неполярным средам, то молекулы ПАВ являются дифильными. Количественно влияние содержания ПАВ в растворе на поверхностное натяжение при постоянной температуре выражается изотермой поверхностного натяжения.
Ионогенные ПАВ в растворе диссоциируют на ионы, а неионогенные в растворе находятся в виде молекул. Неионогенные ПАВ в растворе не диссоциируют на ионы, а находятся в виде молекул. Примером таких ПАВ могут служить спирты.
Опытным путем Траубе установил, что в водных растворах гомологического ряда жирных кислот при переходе от низшего гомолога к высшему поверхностная активность увеличивается в 3 – 3,5 раза. Эта формулировка получила название правила Траубе.
При одинаковой концентрации понижение поверхностного натяжения возрастает при переходе от уксусной кислоты к масляной. Изучение сущности этого явления показало, что изменение поверхностного натяжения раствора объясняется тем, что концентрация ПАВ в объеме раствора и на поверхности “газ – жидкость” – различная.
Поэтому понижение поверхностного натяжения растворителя в присутствии ПАВ можно объяснить концентрированием молекул ПАВ на поверхности раздела фаз «жидкость – газ», т.е. адсорбцией молекул ПАВ. Связь между молярной концентрацией молекул ПАВ в объеме раствора, величиной адсорбции и поверхностной активностью установлена Гиббсом термодинамическим методом.
В работах Гаркинса и Ленгмюра показано, что при адсорбции дифильные молекулы ПАВ ориентируются на поверхности раздела фаз полярными группами в родственную полярную среду, а неполярными радикалами – в неполярную.
Уравнение Гиббса