
- •Министерство образования и науки украины
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
- •Министерство образования и науки украины
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
- •Министерство образования и науки украины
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
Гидроксиды
Гидроксиды: основания, кислоты, амфотерные гидроксиды.
Гидроксиды – это оксиды, которые вмещают воду.
Основания|основание|
1. Основания – продукты прямой или непрямой гидратации основных оксидов.
2. Ме(ОН)n ( n = 1;2) Основания, в которых n = 1 называются однокислотными, при n = 2 - двухкислотными.
3. КОН – гидроксид калия; Ва(ОН)2 – гидроксид бария; Fe(ОН)2 – гидроксид железа (2).
4. Графическая формула К – О - Н
5. Типы связи: К – О – преимущественно ионная, О – Н –ковалентная| полярная.
6. Агрегатное состояние|стан|: твердые кристаллические, имеют высокие температуры плавления и кипения –гидроксиды| металлов 1 группы главной|головной| подгруппы; твердые аморфные – разлагаются|разлагают| при температуре . Хрупкие, нелетучие, не имеют запаха. Гидроксиды, образованные d – металлами могут быть окрашены. Теплопроводность средняя. Электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) в водных растворах диссоциируют с отщеплением ОН- :
гидроксиды металлов 1, II групп главных подгрупп диссоциируют по типу сильных оснований . Такие основания растворимые в воде, сильные электролиты – щелочи. Ме(ОН)n Me+n + nOH-
все другие малорастворимые основания диссоциируют |основа| по типу слабых оснований|основания| :
Me(ОН)2 → MeOH+ + OH- 1 ступень
MeOH+ → Me2+ + OH- 2 ступень
Взаимодействие с|с| :
б) с оксидами : кислотными 2КОН + SiO2 K2SiO3 + H2O амфотерными Sr(OH)2 + A12O3 Sr(A1O2)2 + H2O
в) с гидроксидами: кислотами Mg(OH)2 + H2SO4 MgSO4 + 2H2O
амфотерными| гидроксидами|
Cr(OH)2 + Pb(OH)2 CrPbO2 + 2H2O
г) с солями реагируют в растворах только щелочи
2NaOH + CuSO4 Cu(OH)2 + Na2SO4
д) с амфотерными| металлами реагируют только щелочи
2NaOH + Zn + 2H2O Na2[Zn(OH)4] + H2
е) термолизу подлежат только аморфные основания|основание|
Ca(OH)2 CaO + H2O
8. Получение:
а) прямая гидратация| металлов ( подгруппы Li|, Ca| )
Me + H2O Me(ОН)n + H2
б) прямая гидратация| оксидов|оксида| металлов подгруппы Li|, Ca|
K2O + H2O 2KOH
в) непрямая гидратация| в следствие ионного обмена
FeC12 + 2NaOH Fe(ОН)2 + 2NaC1
Кислоты
1. Кислоты – это продукты прямой или непрямой гидратации кислотных оксидов.
2. Бывают бескислородные (НС1 – хлороводородная кислота ) и кислородсодержащие (Н3РО4 – фосфорная кислота ).
Бескислородные – это продукт растворения в воде газообразных веществ типа: HCl, HBr, HI. H2S, H2Se..
Кислоты, которые имеют в составе|складе| один атом гидрогена| называются одноосновными, два или больше – двухосновными и больше.
3. Номенклатура:
а) кислородсодержащие | кислоты – латинское название кислотообразующего элемента с добавлением|додает| суффикса - ат-|, если элемент имеет максимальную степень окисления, или –ит| -, если элемент имеет промежуточную степень окисления и последующего добавления|додает| окончания – ная и слова кислота.
H2S+4 O3 - сульфитная кислота; H2S+6O4 - сульфатная кислота.
б) бескислородные кислоты – латинское название неметалла, суффикс –ид| -, окончание –ная|, и слово кислота.
H2S - сульфидная кислота; HBr – бромидна кислота.
Графическая формула Н – С1
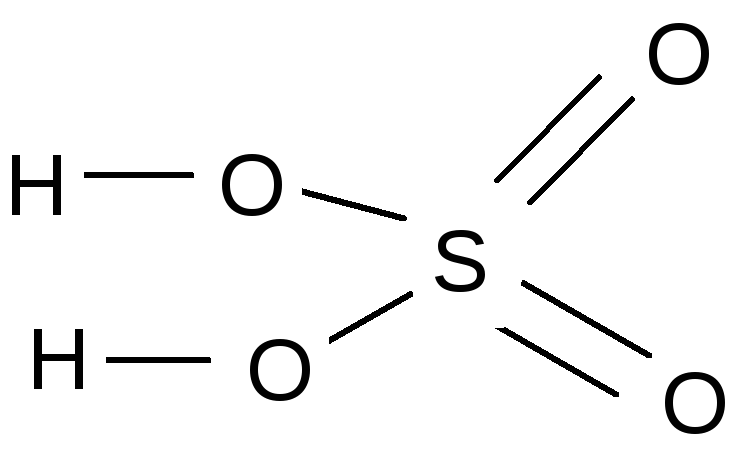
5. Типы связи: Н – С1 - ковалентная| полярная, Н – О – ковалентная| полярная
Р – О – ковалентная| полярная.
6. Агрегатное состояние: жидкие, твердые( H3PO3,H3PO4, H2WO4, HNbO3, HTaO3 , Н3ВО3 );; гелеобразная – H2SіO3, некоторые существуют только в растворах (H2SO3, H2CO3)
средние температуры плавления и кипения, не имеют| запаха и цвета, теплопроводность средняя, электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) растворы кислот диссоциируют с отщеплением Н+ . HNO3 → H+ + NO3-
Взаимодействие:
б) с оксидами: основными MgO + H2SO4 MgSO4 + H2O
амфотерными In2O3 + 6HC1 2InC13 + 3H2O
в) с гидроксидами: основаниями Mg(OH)2 + H2SO4 MgSO4 + 2H2O
амфотерными 3H2SO4 + 2Fe(OH)3 Fe2(SO4)3 + 6H2O
гидроксидами
г) с солями: в растворах при условиях образования труднорастворимых | солей или летучих веществ
H2SO4 + BaC12 BaSO4 ↓ + 2HC1
д) с металлами, которые|какие| стоят в ряду напряжения до водорода||д|
Zn + 2HC1 ZnC12 + H2
е) при нагревании кислородсодержащие | кислоты разлагаются|разлагают|
H2SiO3 H2O + SiO2
7. Способы получения:
а) прямая гидратация| соответствующих оксидов|оксида|, или газов типа HCl|, HBr|;
SO3 + H2O H2SO4
б) непрямая гидратация| в результате|вследствие| ионного обмена:
Na2WO4 + 2HCl → 2NaCl + H2WO4↓
в) общий способ – реакция обмена между солью и менее| летучей кислотой :
NaC1 + H2SO4 HC1 ↑+Na2SO4
