
28+
.pdf
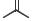
Жерносек А.К. Лекции по фармацевтической химии
ХИНОЛОНЫ |
|
|
|
O |
ИСТОРИЯ СОЗДАНИЯ |
|
|
O |
|||
Хинолоны – синтетические АБ ЛС, в |
1960-е |
|
O |
|
|
||||||
|
COOH |
|
COOH |
||||||||
молекулах содержится фрагмент 1,4- |
США |
|
|
|
|
|
|||||
дигидро-4-оксопиридина: |
|
N |
Cl |
N |
N |
H3C |
N |
N |
|||
|
|
|
|
|
H |
|
|
CH3 |
|
|
CH3 |
O |
|
O |
|
O |
O |
|
|
|
|
||
|
|
побочный продукт синтеза |
Налидиксовая кислота |
||||||||
|
|
|
N |
|
|
||||||
|
|
|
|
N N |
хлорохина |
|
|
O |
|
|
|
|
N |
N |
N |
N |
|
|
|
|
|
||
N |
1979 |
|
F |
|
COOH |
|
|||||
H |
|
H |
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Производные |
Производные |
Производные |
|
|
N |
N |
Норфлоксацин |
|||
Большинство |
нафтиридина |
пиридо[2,3d] |
1,2-циннолина |
|
|
||||||
хинолонов |
Налидиксовая |
пиримидина |
|
|
H N |
|
CH3 |
|
|||
Пипемидиевая |
Цинноксацин |
|
|
|
|||||||
|
кислота |
кислота |
|
|
|
|
|
|
|
|
|
ХИМИЧЕСКОЕ СТРОЕНИЕ
Большинство фторхинолонов
|
|
|
|
|
O |
|
Обязательные |
|||||||
F |
6 |
5 |
|
|
4 |
|
COOH |
элементы |
||||||
|
7 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
8 |
|
N1 |
2 |
|
O |
|||||||
|
|
|
|
|||||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
R3 |
R1 |
F |
|
|
|
|
COOH |
||||
|
|
|
|
|
|
|||||||||
Остаток насыщенного
N-содержащего R2


 N
N гетероцикла X
гетероцикла X
CH3
Трициклические фторхинолоны
КЛАССИФИКАЦИЯ |
Химическая |
|
||
|
|
|||
ЧИСЛО АТОМОВ ФТОРА |
|
|
||
МОНОФТОРХИНОЛОНЫ Большинство ФХ |
||||
ДИФТОРХИНОЛОНЫ |
Ломефлоксацин |
|||
ТРИФТОРХИНОЛОНЫ |
|
O |
||
F |
COOH |
|||
|
|
|||
Флероксацин |
|
N |
N |
|
|
H C N |
F |
F |
|
|
3 |
|
|
|
Фармакологическая (все хинолоны) ПЕРВОЕ ПОКОЛЕНИЕ
Нефторированные хинолоны: кислота налидиксовая, кислота пипемидиевая, кислота оксолиниевая и др.
O
N
 COOH
COOH
 N
N
 N
N
 N
N
HN



 CH3
CH3
Кислота пипемидиевая
Активны в отношении Гр+ МО, не создают высоких концентраций в плазме крови и тканях.
|
Фторхинолоны |
|
ВТОРОЕ ПОКОЛЕНИЕ |
||
первого поколения |
||
|
Разрешены для клинического применения в 1980-х годах (созданы в первой половине 1980-х годов). Обладают более широким спектром антимикробного действия. Хорошо проникают в различные ткани и органы.
Норфлоксацин Офлоксацин Пефлоксацин Ломефлоксацин Ципрофлоксацин
Обладают низкой активностью в отношении МО,
вызывающих пневмонии: Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamidophylla pneumoniae.
2011/2012
1
Жерносек А.К. Лекции по фармацевтической химии
ТРЕТЬЕ ПОКОЛЕНИЕ Фторхинолоны второго поколения
«Респираторные фторхинолоны» - обладают повышенной по сравнению с хинолонами второго
поколения активностью в отношении МО, вызывающих пневмонии. Созданы во второй половине 1980-х годов.
|
O |
Левофлоксацин |
F |
COOH |
 N
N
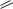
 N
N
H3C N

 O
O
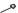

 CH3
CH3
S-энантиомер офлоксацина
ЧЕТВЁРТОЕ ПОКОЛЕНИЕ Фторхинолоны третьего поколения
«Респираторные» + «антианаэробные» фторхинолоны – отличаются от хинолонов третьего поколения повышенной активностью в отношении
анаэробов. Созданы в 1990-х годах.
O
F 
 COOH
COOH
HN |
H |
N |
N |
|
|||
|
|
OCH3 |
|
|
|
H |
|
|
|
|
Моксифлоксацин
ХИНОЛОНЫ В АТХ
J01 Антибактериальные средства для системного применения
J01М Антибактериальные хинолоны
J01MA Фторхинолоны
J01MA01 Офлоксацин J01MA02 Ципрофлоксацин J01MA03 Пефлоксацин J01MA06 Норфлоксацин J01MA07 Ломефлоксацин J01MA12 Левофлоксацин J01MA14 Моксифлоксацин
J01MB Другие хинолоны
J01MB02 Налидиксовая кислота
ДНК-гираза
расплетённая ДНК
спирализованная ДНК
Топоизомераза IV
сплетённая |
расплетённая |
кольцевая ДНК |
кольцевая ДНК |
СВЯЗЬ СТРУКТУРЫ И ДЕЙСТВИЯ
Основной первичной мишенью действия фторхинолонов являются ферменты, ответственные за процесс нормального синтеза ДНК в микробной клетке: ДНК-
гираза (топоизомераза II) – у ГрМО и
топоизомераза IV – у Гр+.
У человека аналогичные ферменты имеют другое строение и не катализируют процесс суперспирализации ДНК.
ФХ связываются с ДНК с образованием комплекса, в который входят 4 молекулы ЛС, ДНК и ингибируемый фермент.
|
Образование водородных |
|
|
связей с ферментом |
|
|
|
O |
Проникновение |
F |
COOH |
|
|
|
ФХ в клетки, |
N |
N |
взаимодействие |
||
с ферментом |
HN |
|
Самоассоциация молекул ФХ
2011/2012
2
Жерносек А.К. Лекции по фармацевтической химии
|
Обязательные группы. Замена на |
||
|
аналогичные приводит к резкому |
||
|
снижению или утрате активности |
||
R5 |
O |
|
Нет заместителей. |
R6 |
|
COOH |
Введение –CH3 или –SCH3 |
|
|
|
из-за стерического |
R7 |
N |
|
влияния дезактивирует |
R8 |
R1 |
|
молекулу ФХ |
|
|
||
Азот – важен. Замена N на С, O или S приводит к |
|||
уменьшению или исчезновению активности. |
|||
Оптимальный R1 |
– циклопропил или этил. В R1 |
||
может содержаться атом фтора. |
|||
|
O |
pKa 6 |
F |
O |
COO |
F |
|
COOH |
|
||
|
|
OH- |
|
|
OH- |
N |
N |
H+ |
N |
N |
H+ |
N |
R1 |
N |
|
R1 |
|
R2 H pK |
+ 9 |
R2 H |
pH 7,4 |
|
|
BH |
|
O |
|
|
|
|
|
|
|
|
|
|
F |
|
COO |
|
|
|
|
|
|
|
|
|
|
|
pI = (6 + 9)/2 = 7,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
N |
||||
|
|
|
|
|
|
|
|
|
|
R2 |
N |
|
|
R1 |
|
||||
В молекулу специально введен такой ГЦ, чтобы
изоэлектрическая точка ФХ была близка к рН крови. При рН около 7,4 ФХ находятся в водной фазе в виде цвиттер-ионов, поэтому хорошо диффундируют через БМ и проникают в ткани.
По разному влияет на активность. |
|||
Аминогруппа увеличивает, |
|||
CH3NH- - уменьшает |
|
||
Обычно атом фтора. |
R5 |
O |
|
Увеличивает активность, |
R6 |
COOH |
|
улучшает фармакокинетику. |
|
|
|
Не является обязательным |
R7 |
N |
|
элементом структуры |
R8 |
R1 |
|
|
|||
Обычно остатки 4-6 членных |
Увеличивают |
||
насыщенных N-содержащих |
|||
активность атомы |
|||
гетероциклов. Придаёт ФХ |
|||
галогенов, |
|||
амфотерные свойства и |
|||
метоксигруппа и |
|||
улучшает фармакокинетику |
|||
замещение C8 на N |
|||
|
|||
ЦИПРОФЛОКСАЦИНА ГИДРОХЛОРИД |
|
|||||
(CIPROFLOXACIN HYDROCHLORIDE) |
|
|||||
|
|
O |
|
|
ЦИПРОБАЙ |
ЦИПРИНОЛ |
|
F |
COOH |
||||
|
CNS-ЦИПРО |
ЦИПРОКС |
||||
|
|
|
H |
O |
ВИПРОЛОКС |
ЦИПРОЛЕТ |
Cl |
N |
N |
МИКРОФЛОКС |
ЦИПРОМЕД |
||
2 |
|
ФЛОКСИМЕД |
ЦИПРОНЕКС |
|||
H2N |
|
|
|
|
ЦИЛОКСАН |
ЦИФРАН |
|
|
|
|
|
Ц-ФЛОКС |
|
1,4-дигидро-4-оксо-7-(1-пиперазин)-1- |
|
|
||||
циклопропил-6-фторхинолин-3- |
|
|
|
|
||
карбоновой кислоты гидрохлорид |
|
|
|
|
||
моногидрат |
|
|
|
|
|
|
Таблетки ПО по 250, 500 и 750 мг; капсулы по |
||||||
250 и 500 мг; раствор для инфузий 0,8 и 2 мг/мл; |
||||||
капли глазные и ушные 0,3%; мазь глазная 0,3%. |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПЕФЛОКСАЦИНА МЕЗИЛАТ |
|
|
|
НОРФЛОКСАЦИН |
|
|
|
|
|
||||||||||||||||
|
(PEFLOXACIN MESILATE) |
|
|
|
(NORFLOXACIN) |
|
|
|
|
ЛОКСОН |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
O |
|
|
АБАКТАЛ |
|
|
|
|
|
|
|
|
НОЛИЦИН |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
F |
|
|
|
COOH |
|
|
|
F |
|
|
|
COOH |
НОРБАКТИН |
||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НОРИЛЕТ |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
НОРМАКС |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
||||||||||
|
|
|
N |
N |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
H |
|
|
CH |
|
|||||||||
|
H3C |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
3 |
|
|||||
|
H CH3SO3 |
|
|
|
|
1,4-дигидро-7-(1-пиперазинил)-4-оксо- |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-6-фтор-1- |
|
|
6-фтор-1-этилхинолин- 3-карбоновая |
|
|||||||||||||||||||||
|
|
|
|
|
кислота |
|
|
|
|
|
||||||||||||||||
|
этилхинолин- 3-карбоновой кислоты метансульфонат |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
Таблетки ПО по 400 мг; раствор для инфузий |
|
|
Таблетки ПО по 200 и 400 мг; капли глазные |
||||||||||||||||||||||
|
400 мг/5 мл. |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
и ушные 0,3%. |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2011/2012
3
Жерносек А.К. Лекции по фармацевтической химии
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТАВАНИК |
|
ОФЛОКСАЦИН |
|
|
|
|
|
|
|
|
|
ЛЕВОФЛОКСАЦИН |
|
|
|
|||||||||||
|
(OFLOXACIN) |
|
|
|
|
|
|
|
|
|
(LEVOFLOXACIN) |
|
|
|
ВИТАЛЕЦИН |
||||||||||
|
|
|
|
|
|
|
O |
ТАРИВИД |
|
|
|
|
|
|
|
|
|
|
|
|
|
ГИРАЦИН |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛЕБЕЛ |
|||||
|
|
F |
|
|
|
|
|
COOH |
ВИТОФЛОН |
|
|
|
|
|
|
|
|
|
O |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
ЗАНОЦИН |
|
|
|
F |
|
|
|
|
|
COOH |
ЛЕВОПРИМ |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
ОФЛО |
|
|
|
|
|
|
|
|
|
|
ЛЕФЛОКС* |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
N |
|
|
N |
ОФЛОКСИН |
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛОТОР |
|||||
|
|
|
|
ОФЛОМАКС |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
УЛЬТРАЦИН |
|
|
|
N |
|
|
|
N |
|
0,5H2O |
ОФТАКВИКС |
|||
|
H3C N |
O |
|
|
CH3 |
ФЛОКСАЛ |
|
|
|
|
|
|
|
|
|
|
|
|
|
РЕМЕДИЯ |
|||||
|
(RS)-2,3-дигидро-3-метил-10-(4-метил-1- |
ФЛОКСИМЕД |
|
|
H3C N |
|
|
O |
|
CH3 |
|
||||||||||||||
пиперазинил)-7-оксо-9-фтор-7H-пиридо-[1,2,3- |
|
|
|
(S)-2,3-дигидро-3-метил-10-(4-метил-1- |
|
||||||||||||||||||||
|
de][1,4]бензоксазин-6-карбоновая кислота |
|
|
|
|
||||||||||||||||||||
|
|
|
|
пиперазинил)-7-оксо-9-фтор-7H-пиридо- |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
Таблетки ПО и капсулы по |
|
|
|
[1,2,3-de][1,4]бензоксазин-6-карбоновая |
|
|||||||||||||||||||
|
|
|
|
|
кислота гемигидрат |
|
|
|
|||||||||||||||||
|
200 мг; раствор для инфузий |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
2 мг/мл; мазь глазная 0,3%. |
|
|
Таблетки ПО по 250, 500 и 750 мг; капсулы по 250 мг; |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
раствор для инфузий 5 мг/мл; капли глазные 0,5%. |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛОМЕФЛОКСАЦИНА ГИДРОХЛОРИД |
||||
(LOMEFLOXACIN HYDROCHLORIDE) |
||||
|
|
O |
|
ЛОМИТАС |
|
F |
|
COOH |
|
H3C |
|
|
|
ЛОФОКС |
N |
N |
|
|
|
H2N |
|
F |
CH3 |
|
Cl |
|
|
|
|
1,4-дигидро-7-(3-метил-1-пиперазинил)-4-оксо- |
||||
6,8-дифтор-1-этилхинолин- 3-карбоновой |
|
|||
кислоты гидрохлорид (или мезилат) |
|
|||
Таблетки ПО по 400 мг; |
|
|||
капли глазные 0,3%. |
|
|
||
МОКСИФЛОКСАЦИНА ГИДРОХЛОРИД |
|||||
(MOXIFLOXACIN HYDROCHLORIDE) |
|||||
|
|
|
O |
|
АВЕЛОКС |
|
|
F |
|
COOH |
|
|
Cl |
|
|
H2O |
ВИГАМОКС |
H2N |
N |
N |
|
||
|
|
||||
|
|
OCH3 |
|
|
|
|
|
|
|
|
|
7-[(1S,6S)-2,8-диазабицикло |
|
|
|||
[4.3.0]нон-8-ил]-8-метокси-4-оксо-6-фтор-1- |
|
||||
циклопропилхинолин-3-карбоновой кислоты |
|
||||
гидрохлорид моногидрат |
|
|
|||
Таблетки ПО по 400 мг; раствор для инфузий |
|||||
400 мг/250 мл; капли глазные 0,5%. |
|||||
ПРИМЕРЫ СИНТЕЗА ФТОРХИНОЛОНОВ
В качестве исходных соединений для получения ФХ используют вещества, уже содержащие атомы фтора в определённых положениях молекулы. Это обусловлено тем, что прямое введение атомов фтора в ароматическое кольцо (например, в молекулу нефторированного хинолона) связано со значительными трудностями.
ФХ синтезируют двумя путями:  из 4-фторпроизводных анилина
из 4-фторпроизводных анилина
 из фторпроизводных бензойной кислоты.
из фторпроизводных бензойной кислоты.
Для получения этих веществ используют реакции SN галогена или диазогруппы фторид-ионом.
Cl |
KF |
F |
[H] |
F |
|
|
|
Cl
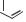
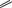
 NODMSO2 Cl
NODMSO2 Cl

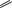
 NO2 Cl
NO2 Cl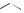
 NH2
NH2
2011/2012
4
Жерносек А.К. Лекции по фармацевтической химии
Синтез на основе фторанилинов |
|
|
|
|
||||
F |
C2H5O |
COOC2H5 |
|
F |
C2H5OOC |
COOC2H5 |
||
|
+ |
|
|
|
|
|
|
|
|
|
-C2H5OH |
|
|
-C2H5OH |
|||
Cl |
NH2 |
|
Cl |
N |
||||
|
COOC2H5 |
|
|
|
||||
F |
O |
COOC2H5 1) C2H5Br |
|
O |
H |
|
|
|
|
F |
|
COOH R N |
N H |
||||
|
|
|
2) H+,H2O |
|
|
|
|
|
Cl |
N |
|
O |
Cl |
N |
|
DMSO |
|
|
|
|
|
|||||
|
H |
F |
|
COOH |
|
CH3 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
N |
N |
|
|
|
|
|
|
R N |
|
CH |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
Фторанилины конденсируют с этоксиметиленмалоновым эфиром, |
||||||||
затем проводят внутримолекулярную циклизацию с замыканием |
||||||||
пиридонового цикла по реакции Гоулда-Джекобса, после чего |
||||||||
NH-хинолон алкилируют, гидролизуют и замещают атом |
|
|||||||
галогена в положении 7 на остаток пиперазина |
|
|
||||||
|
O |
|
|
|
|
|
O |
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
Cl (H C) N |
COOC H |
F |
|
|
COOC2H5 |
|
NH2 |
||||
|
|
|
|
||||||||
|
|
3 |
2 |
2 |
5 |
|
|
|
|
|
|
Cl |
Cl |
|
N(C2H5)3 |
Cl |
|
Cl |
N(CH3)2 |
|
|
||
|
|
|
O |
|
|
||||||
|
O |
|
|
|
|
|
|
|
|
|
|
F |
|
|
COOC2H5 |
F |
|
|
COOC2H5 |
|
+ |
|
|
|
|
|
|
NaH |
|
|
|
|
1) H ,H2O |
||
Cl |
Cl |
NH |
Cl |
|
N |
|
2)R N |
N H |
|||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
F |
|
|
COOH |
|
|
|
|
|
|
|
|
N |
|
N |
|
|
|
|
|
|
|
|
HN |
|
|
|
|
|
|
|
|
|
Синтез на основе фторпроизводных БК
Используется, например, при получении ципрофлоксацина из-за невозможности проалкилировать хинолины бромциклопропаном. Хлорангидрид тригалогенбензойной кислоты конденсируют с 3-диметиламиноакрилатом с образованием аминовинилкетона. Затем диметиламинный фрагмент замещают аминоциклопропаном. После этого проводят циклоконденсацию циклопропиламиновинильного производного в присутствии гидрида натрия, гидролиз и замещение атома хлора при С-7 на пиперазинильный остаток
МЕТОДЫ КОНТРОЛЯ КАЧЕСТВА ФТОРХИНОЛОНОВ
Характеристика веществ
ФХ представляют собой белые или бледно-жёлтые кристаллические вещества (офлоксацин может быть ярко-жёлтым, моксифлоксацина г/х - жёлтым).
Некоторые из ФХ гигроскопичны и являются кристаллогидратами. ЛС данной группы чувствительны к действию света.
Несолевые формы ФХ обладают незначительной растворимостью в воде и этаноле. Солевые формы данных веществ значительно лучше растворимы в воде, но мало растворимы в этаноле. Из-за своей амфотерности фторхинолоны способны растворяться в растворах кислот и щелочей.
ЦИП |
ЦИП г/х |
ПЕФ м/т |
НОР |
ОФЛО |
МОКС г/х |
Почти Б |
Бледно-ж. |
Тонкий |
Белый |
Бледно-ж. |
Бледно-ж. |
или бл.-ж. |
КП, слегка |
белый |
или бл.-ж. |
или ярко- |
или ж. П |
КП, слегка |
гигроскоп. |
или почти |
КП, гигр., |
ж. КП |
или крист., |
гигроскоп. |
|
белый П. |
фоточув. |
|
слегка гигр. |
|
ЦИП |
ЦИП г/х |
ПЕФ м/т |
НОР |
ОФЛО |
МОКС г/х |
Вода |
ПрН |
Р |
Л |
ОМ |
М |
У |
EtOH |
ОМ |
ОМ |
М |
М |
|
М |
MeOH |
|
М |
|
|
М |
|
CH2Cl2 |
ОМ |
ПрН |
ОМ |
|
М или Р |
|
EtOAc |
|
ПрН |
|
|
|
|
Ацетон |
|
ПрН |
|
М |
|
ПрН |
Лед. AcOH |
|
|
|
|
|
|
2011/2012
5
Жерносек А.К. Лекции по фармацевтической химии
Идентификация
Для идентификации ФХ используют ИК- (в ЛФ иногда УФ- и хроматографические методы (ТСХ, ВЭЖХ)). Химические реакции (за исключением реакции на Cl-) для идентификации данных веществ в НД практически не применяются (в том числе и обнаружение органически связанного фтора!!!).
ЦИП |
ЦИП г/х |
ПЕФ м/т |
НОР |
ОФЛО |
МОКС г/х |
|
|
ИК-спектрометрия |
|
|
|
|
|
|
УФ (гл. |
|
|
|
|
|
капли) |
|
|
|
|
|
|
|
[ ] от -125 |
|
|
|
|
|
до -138 |
|
ТСХ и |
ТСХ |
ТСХ (в |
|
|
|
ВЭЖХ (в |
(мезилаты) |
таблетках) |
|
|
|
таблетках) |
|
|
|
|
|
Хлориды |
|
|
|
Хлориды |
Чистота |
|
|
|
|
|
Определяют обычные показатели: П и Ц раствора, рН |
|||||
растворов для солевых форм, m при высушивании |
|||||
или W для кристаллогидратов, тяжелые металлы, |
|||||
сульфатную золу. Для ОФЛО – оптическое вращение, |
|||||
МОКСИ г/х – удельное вращение. |
ВЭЖХ, для |
||||
Специфические примеси: |
|
||||
|
некоторых |
||||
|
промежуточные продукты синтеза; |
||||
|
продукты разрушения. |
|
примесей - |
||
|
|
ТСХ |
|||
|
O |
|
|
O |
|
|
|
|
|
||
F |
COOH |
F |
|
COOH |
|
Cl |
N |
|
HN |
N |
Например для |
|
НОР |
||||
|
CH3 |
H2N |
|
|
|
|
|
CH3 |
|||
|
|
|
|||
примесь А (синтез) |
примесь B (фотохимическое разрушение) |
||||
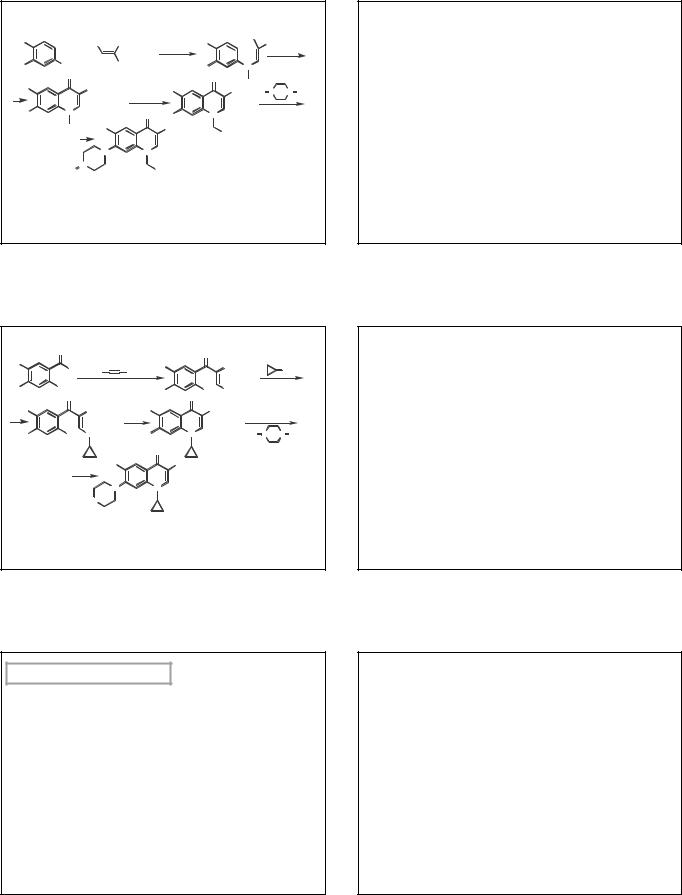
Спектры поглощения в УФ-области
Содержат несколько полос и зависят от рН. В 0,1 М HCl
наиболее интенсивная полоса поглощения ЦФ, НФ, ПФ имеет максимум при 278 нм, ЛФ - 288 нм, ОФ
– 294 нм.
40 |
|
|
|
30 |
|
|
|
20 |
|
|
|
10 |
|
|
|
0 |
|
|
|
200 |
250 |
300 |
350 |
В щелочной среде происходит небольшое гипсохромное смещение (на 5-7 нм) с гипохромным эффектом.
|
|
|
|
|
|
|
|
|
|
|
ЦИП |
ЦИП г/х |
ПЕФ м/т |
НОР |
ОФЛО |
МОКС г/х |
|
|
П и Ц. |
+ |
+ |
+ |
+ |
A при |
+ |
|
|
|
|
|
|
|
440 нм |
|
|
|
К или |
|
pH = |
pH = |
|
|
pH = |
|
|
Щ |
|
3,5-4,5 |
3,5-4,5 |
|
|
3,9-4,6 |
|
|
|
|
(W;2,5%) |
(W;1%) |
|
|
(W;0,2%) |
|
|
СПр |
ВЭЖХ |
ВЭЖХ |
ВЭЖХ |
ВЭЖХ |
ВЭЖХ |
ВЭЖХ |
|
|
|
|
|
|
|
от -0,10 |
|
|
|
|
|
|
|
|
до +0,10º |
|
|
|
ТМ |
+ |
+ |
+ |
+ |
+ |
|
|
|
m |
н.б. 1% |
н.б. 6,7% |
W - 7,0- |
н.б. 1% |
н.б. |
|
|
|
|
|
|
8,5% |
|
0,2% |
|
|
|
CЗ |
+ |
+ |
+ |
+ |
+ |
|
|
|
ОКОР, МЧ |
+ |
+ |
|
|
+ |
|
|
|
+ more |
Прим. |
Прим. А - |
|
|
Прим. А |
|
|
|
|
А - ТСХ |
ТСХ |
|
|
– ТСХ. |
|
|
|
|
|
|
|
|
|
|
|
Количественное определение
ЛС |
Метод |
ЦИП Ацидиметрия (лед. AcOH; 0,1 М HClO4; потенц.)
ЦИП г/х ВЭЖХ (С18; ПФ – смесь (13:87) MeCN и раствора H3PO4
(+Et3N до рН 3,0); 278 нм).
Таблетки – ВЭЖХ (как и в субстанции)
ПЕФ м/т Ацидиметрия (AcOH + Ac2O; 0,1 М HClO4; потенц.)
НОР Ацидиметрия (безв. AcOH; 0,1 М HClO4; потенц.)
Таблетки – ВЭЖХ (С18; 40ºС; ПФ – смесь (150:850) MeCN и 0,1% H3PO4; 275 нм.)
ОФЛО Ацидиметрия (безв. AcOH; 0,1 М HClO4; потенц.)
МОКС ВЭЖХ (фенилсилилСГ; 45ºС; ПФ – смесь (28:72) MeOH г/х и водного раствора, содержащего гидросульфат ТБА,
KH2PO4 и H3PO4; 293 нм.)
|
|
O |
|
|
|
O |
|
F |
|
COOH |
|
F |
COOH |
|
N |
N |
+ HClO4 |
N |
N |
|
|
|
|
||||
HN |
|
|
H2N |
|
||
|
|
|
|
ClO4 |
|
|
|
F |
O |
COOH |
|
|
O |
|
|
|
F |
COOH |
||
|
N |
N |
+ HClO4 |
N |
N + CH3SO3H |
|
H3C |
N |
|
CH3 |
H3C |
N |
CH3 |
|
H CH3SO3 |
|
|
|
H ClO4 |
|
2011/2012
6

Жерносек А.К. Лекции по фармацевтической химии
Нефармакопейные методы
 Флуориметрия (ФХ обладают интенсивной флуоресценцией!);
Флуориметрия (ФХ обладают интенсивной флуоресценцией!);
 Фотометрия на основе реаций образования
Фотометрия на основе реаций образования
окрашенных соединений; Комплексы с катионами металлов; Комплексы с переносом заряда;
Ионные ассоциаты (в т.ч. экстрагирующиеся)
 Вольтамперометрия и др.
Вольтамперометрия и др.
Me(n-1)
O
 O
O
F


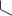

 O
O  N
N

 N
N
N |
|
|
|
|
R1 |
||
|
|||
R2 |
|
|
|
ИСТОРИЯ СОЗДАНИЯ
Конец 1950-х открытие способности оксазолидинонов ингибировать МАО.
1970-е открытие исследователями duPont антимикробной активности.
1978 г. - duPont запатентовал серию оксазолидинонов как эффективных средств для лечения бактериальных и грибковых заболеваний растений.
1984 г. – патент на использование оксазолидинонов для лечения бактериальных заболеваний животных.
Большинство исследованных соединений обладало гепатотоксичностью, поэтому процесс изучения оксазолидинонов был прекращён.
ОКСАЗОЛИДИНОНЫ
Оксазолидиноны – группа синтетических антибактериальных лекарственных средств,
в основе которых лежит структура (S)-3- фенил-5-метил-2-оксазолидинона :
O
3 
 2
2

 N O1
N O1
4 5 CH3
CH3
Как и фторхинолоны оксазолидиноны не являются антибиотиками (в классическом понимании этого термина).
1987 г. – Учёные duPont опубликовали подробное описание оксазолидинонов как нового класса АБС с принципиально новым механизмом действия.
1990-е – начало исследовательской программы по оксазолидинонам компании Pharmacia & Upjohn (сейчас входит в Pfizer). Создание линезолида.
18.04.2000 – разрешение FDA;
06.2000 – Бразилия;
01.2001 – Великобритания;
04.2001 – Япония и Канада;
2001 - многие страны Европы, Азии и Латинской Америки.
МЕХАНИЗМ ДЕЙСТВИЯ
Ингибиторы синтеза белка. Останавливают процесс инициации (другие ЛС действуют на стадии элонгации!)
Связываются с 23S фрагментом 50S СЕ рибосомы и предотвращают образование комплекса, состоящего из 30S и 50S СЕ рибосом, тРНК и мРНК.
Линезолид эффективен в отношении всех имеющих клиническое значение Гр+ бактерий, особенно:
 Enterococcus faecium и Enterococcus faecalis (включая ванкомицин-устойчивые энтерококки),
Enterococcus faecium и Enterococcus faecalis (включая ванкомицин-устойчивые энтерококки),
 Staphylococcus aureus (включая метициллин-устойчивые Staphylococcus aureus),
Staphylococcus aureus (включая метициллин-устойчивые Staphylococcus aureus),
 Streptococcus agalactiae,
Streptococcus agalactiae,
 Streptococcus pneumoniae,
Streptococcus pneumoniae,
 Streptococcus pyogenes.
Streptococcus pyogenes.
Практически неэффективен в отношении Гр-
бактерий; Pseudomonas и Enterobacteriaceae.
2011/2012
7
Жерносек А.К. Лекции по фармацевтической химии
СВЯЗЬ СТРУКТУРЫ И ДЕЙСТВИЯ
CH3CO-, CH3SO-, |
|
|
|
Арил при N |
|
|||
арил, гетероарил, Может быть |
|
|
Важны для проявления |
|||||
морфолинил, |
|
ещё один -F |
|
|
фармакологической |
|||
пиперазинил и др. |
|
|
||||||
|
|
|
|
|
активности |
|||
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
|||
|
|
|
|
|
|
O |
|
|
Обычно ЭД |
|
N |
|
O |
|
|||
атом азота |
F |
|
|
|
|
|
R |
|
|
|
|
|
|
|
|||
Фтор сильнее |
|
|
|
|
|
|
N |
|
нет заместителей |
|
|
H |
-CH3, -H, |
||||
всего |
|
|
|
|
|
|
|
-OCH3, - CHCl2 |
увеличивает |
|
|
|
|
|
|
|
|
|
|
S-конфигурация |
|
|||||
активность |
|
|
|
|||||
O |
N |
O |
|
|
|
|
|
||
|
|
|
Линезолид |
|
|
N |
O |
O |
|
|
CH3 |
|||
|
F |
|
N |
|
|
|
|
H |
|
|
|
|
|
Некоторые оксазолидиноны, находящиеся на разных стадиях клинических испытаний:
N |
N |
|
O |
|
Радезолид |
|
N |
|
H |
N |
O |
O |
|
N |
|
|
CH3 |
|||
|
|
F |
|
|
||
H |
N N |
|
|
|||
N |
|
N |
||||
H3C N |
|
|
||||
N |
|
O |
|
H |
||
|
|
|
N O |
|
Торезолид |
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
OH |
ЛИНЕЗОЛИД
(LINEZOLID)
ЗИВОКС
O N
N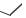

 O
O
N |
O |
O |
F |
|
CH3 |
|
|
N |
|
|
H |
(S)-N-({3-[3-фтор-4-(морфолин-4-ил)фенил]-2-
оксо-1,3-оксазолидин-5-ил}метил)ацетамид
Таблетки ПО по 600 мг; раствор для инфузий 2 мг/мл в пакетах по 100 и 300 мл.
Синтез линезолида достаточно сложный, требует дорогих реагентов, поэтому стоимость данного ЛС высока: таблетки Зивокс 600 мг N 10 – около 5,6
млн. BYR. (в Москве 17-19 тыс. RUR)
Подробную и свежую информацию о химических свойствах оксазолидинонов, связи структуры и действия, способах синтеза, создании новых ЛС можно найти в этой статье:
http://downloads.hindawi.com/journals/ijmc/2012/159285.pdf
2011/2012
8
