
- •Міністерство України з питань надзвичайних ситуацій та у справах захисту населення від наслідків Чорнобильської катастрофи
- •Хімія, як наука про речовини, їх перетворення і явища, що супроводжують ці перетворення
- •Основні закони хімії.
- •Склад речовини можна виразити за допомогою хімічної формули, яка показує кількісний і якісний склад, а також одну молекулу речовини. Наприклад:
- •Періодична система елементів і будова атома
- •Якщо провести аналогію між будовою електронної оболонки атома і положенням елемента в системі, можна зробити цікаві висновки.
- •Хімічний зв’язок і будова молекул
- •Механізми утворення ковалентного зв’язку
- •Напрямленість ковалентного зв’язку
- •Гібридизація атомних електронних орбіталей
- •Метод молекулярних орбіталей
- •Водневий зв’язок
- •Металічний зв’язок
- •Контрольні завдання
- •Загальні закономірності хімічних процесів
- •Необоротні і оборотні хімічні реакції. Хімічна рівновага в гомогенних і гетерогенних системах.
- •Контрольні завдання
- •Модуль 3
- •3) Дифузія – рівномірний розподіл сольватованих частинок в розчиннику – цей процес супроводжується поглинанням теплоти.
- •Константа є сталою при даній температурі величиною і називається іонним добутком води.
- •Реакції обміну в розчинах електролітів. Іонні рівняння.
- •Контрольні завдання
- •Контрольні завдання
Водневий зв’язок
Під час сполучення атома водню з сильно електронегативним елементом (фтором, киснем, азотом тощо) може утворитися ще один додатковий зв’язок – водневий. Він виникає між електронегативними елементами сусідніх молекул за допомогою атома водню. Не ослаблюючи зв’язку з атомом елемента, з яким він утворює полярний ковалентний зв’язок, атом водню притягує електрони від іншої молекули. Цю здатність атома водню можна пояснити його малим розміром і здатністю проникати в електронні оболонки інших атомів. Наприклад:
+ - + - + - + - + - + -
H – F … H – F … H – F … H – F … H – F … H – F.
Водневі зв’язки зумовлюють утворення асоціатів багатьох сполук, що мають сильно поляризовані сполучення. Вода, аміак, спирти та інші рідини, де в сполуках атом водню зв’язаний з електронегативним атомом іншого елементу, відрізняються здатністю до асоціації. Асоціацією зумовлено підвищення температур плавлення, кипіння і теплоти пароутворення речовин.
Металічний зв’язок
Природу хімічного зв’язку в металах можна пояснити, виходячи з двох характерних особливостей металів, які відрізняють їх від як від ковалентних так і від іонних сполук. Метали, по-перше, порівняно з іншими речовинами проявляють високі електро- і теплопровідність, по-друге, за звичайних умов вони є кристалічними речовинами. З першої особливості металів можна зробити висновок, що частина електронів може переміщуватись по всьому зразку металу, з другої – що атоми металу не сполучені один з одним локалізованими двохелектронними зв’язками , оскільки валентних електронів атома металу недостатньо для утворення подібних зв’язків з усіма сусідніми атомами.
Таким чином, металічний зв’язок виникає за разунок електростатичного притягування між іонами металу і узагальненими електронами всіх атомів металу.
Завдяки особливостям металічного зв’язку, метали володіють такими фізичними властивостями, як теплопровідність, електропровідність, пластичність, ковкість, міцність.
Контрольні завдання
Обчисліть масову частку %, елементів, що входять до сполук: а/ ортофосфатна кислота; б/ гідроксид кальцію; в/ гідоксо-карбонат алюмінію.
До розчину, який містить 0,5 моль їдкого калію, долили розчин, який містить 0,76 моль азотної кислоти. Скільки грамів і якої речовини не прореагувало?
При плавлені оксиду олова /IV/ з їдким натром утворюється соль металооловяної кислоти і води. Обчисліть маси реагентів, необхідних для реакції, якщо утворюється 24,8 г Na2SnO3.
Під час випалення піриту протікає реакція
4FeS2+H2O![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
Обчисліть об’єм оксиду сірки /IV/ /н.у./ і масу оксиду заліза /III/, які утворюються із 10 кг піриту, який містить 5% домішок.
Обчисліть масу заліза, яке можна одержати із 2 т залізної руди, яка містить 86% Fe2O3, якщо в якості відновника використовується кокс /вуглець/.
Молекула речовини має масу 1,66. 10-22г. Чому дорівнює а/ молярна маса, б/ маса 0,5 моль речовини?
Який об’єм при н.у. займають 2,69-1022 молекул газа? Визначте моляру масу газу, якщо обчислений об’єм має масу 1,25г.
Із 1,35г оксиду метал одержується 3,15 г нітрату. Обчисліть молярну масу еквіваленту металу.
В 2,48 оксиду одновалентного металу міститься 1,84 г метану. Чому дорівнюють молярна і атомна маса метану?
Із 3,31 г нітрату метану одержується 2,78 г його хлориду. Обчисліть молярну масу еквіваленту метану.
Під час спалювання магнію в надлишок кисню утворюється 8,0 г M2O. Визначте число еквівалентів і об’єм кисню /н.у./ , які при цьому витрачені.
Вміст хлору / M3Cl=35,5г/моль/ в 10,3 хлориду титану складає 7,1 г. Обчисліть молярну масу еквіваленту і валентність титана. Складіть формулу сполуки.
Молярна маса фосфату тривалентного металу 342г/моль. Назвіть формулу солі, якщо молярна маса еквіваленту фосфату метану 57г/моль.
1.14. Що таке ізотопи? Скільки
протонів, нейтронів і електронів
міститься в ізотопах кальцію: а/
![]() Ca;
б/
Ca;
б/![]() Ca;
в/
Ca;
в/![]() Ca?
Ca?
Мідь в природі зустрічається у вигляді ізотопів з масовими числами
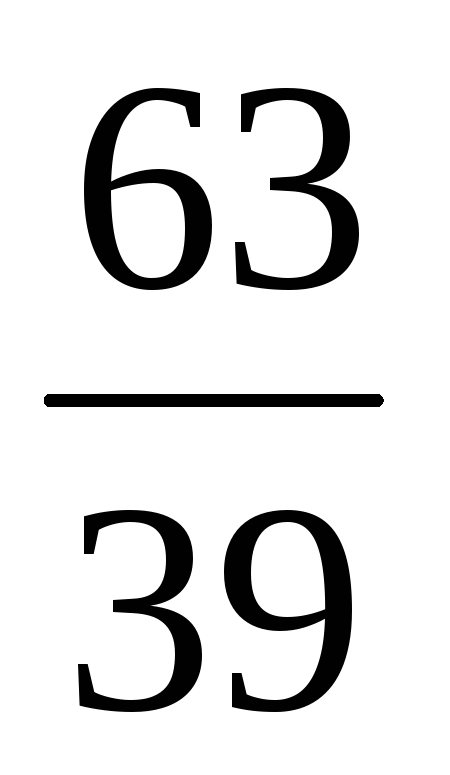 Cu
і
Cu
і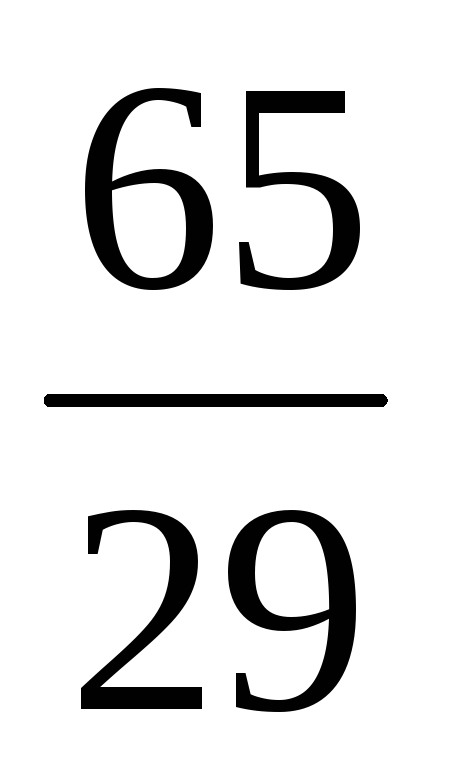 Cu,вміст яких складає 73
і 27% відповідно. Обчисліть середню
атомну масу елементу міді.
Cu,вміст яких складає 73
і 27% відповідно. Обчисліть середню
атомну масу елементу міді.Які значення може приймати головне квантове число n? При яких значеннях n електрон володіє найбільшою і найменшою енергією?
Яке квантове число характеризує форму атомних орбіталей? Вкажіть максимально можливе число електронів на орбіталях: а/ p; б/ d; в/ f.
Розташуйте атомні орбіталі: 4s, 3d, 4d, 5s, 4p, в порядку зростання їх енергії. Наведіть обґрунтування.
Які атомні орбіталі заповнюються електронами раніше: а/ 4s або 3d; б/ 5p або 4d; в/ 5d або 4f ? Відповідь поясніть.
Які властивості електрона характеризує спінове квантове число? Чому дорівнює сумарний спін для п’яти електронів на d-орбіталі?
Складіть електронні формули атомів елементів: а/ алюмінію, б/ хрому, в/ цезію.
Атомами яких елементів і яким станам /нормальному або збудженому/ відповідають слідуючі формули: а/ 2s2
 2s1
2p1
б/ 3s2
2s1
2p1
б/ 3s2 3p2
3s1
в/ 4s24p5
3p2
3s1
в/ 4s24p5 4s24p34d2?
4s24p34d2?Складіть електронні формули: а/ атому стронція, б/ іона хрому Cr3+ , іон хлору Cl-,
Складіть електронні формули: а/ атому заліза, б/ йону сірки S2- в/ йону міді Cu2+.
Електронна конфігурація атома елементу виражається формулою 1s2 2s2 2p2 3s2 3p6 3d10 4s2 4p5. Вкажіть положення елементу в періодичній таблиці /період, ряд, група, підгрупа/, а також його найвищий та найнищий ступені окислення.
Що таке енергія йонізації? Як залежить енергія йонізації /І/ від атомного номера для елементів IА і IIА груп періодичної системи. Встановіть закономірність.
Що таке електронегативність? Як залежить електронегативність від атомного номера для елементів VIIА групи періодичної системи? Відповідь поясніть на конкретних прикладах.
Що таке орбітальний радіус і як впливає збільшення радіуса атома на проявлення металічних властивостей простих тіл в межах головних підгруп періодичної системи? Відповідь поясніть на конкретних прикладах.
Складіть електронні формули атомів ренію і марганцю. У якого з елементів переважає енергія іонізації більше.
Який взаємозв’язок між електронною структурою атомів і їх положенням в періодичній системі.
У якого з елементів-кальцію або цинку-більш виражені металічні властивості? Відповідь обґрунтуйте на основі аналізу електронних формул Ca і Zn.
До якого сімейства /s, p, d, f / належить елементи з атомними номерами 24 і 54. Визначте їх положення в періодичній системі Д.І. Менделєєва /період, група, ряд, підгрупа/.
Визначте положення сірки і хрому періодичні системі Д.І. Менделєєва /період, група, ряд, підгрупа/. Хром-металічний елемент, сірка належить до неметалів. Поясніть різницю, виходячи із електронної будови атомів.
Дані елементи Co, I, Sn, Cs, S. Розташуйте їх в порядку зростання: а/ атомних мас, б/ атомних радіусів, в/ зарядів ядер атомів, г/ металічних властивостей.
Розподіліть електрони атому фосфору по квантовим коміркам. Скільки неспарених електронів може бути у атома фосфору в нормальному і збудженому стані, Яку валентність при цьому проявляє фосфор?
Розподіліть електрони атому хлору по квантовим коміркам. Скільки неспарених електронів може бути у атома хлору, в нормальному і збудженому стані, Яку валентність хлор при цьому проявляє?
Розподіліть електрони атому вуглецю по квантовим коміркам. Скільки неспарених електронів може бути у атома вуглецю, в нормальному і збудженому стані, Яку валентність вуглець при цьому проявляє?
Опишіть, що означають кількісні характеристики хімічного зв’язку: довжина, енергія, кратність, валентний кут, полярність?
Що таке енергія, довжина, кратність зв’язку? Який взаємозв’язок між ними? Наведіть приклади сполук з кратними зв’язками.
Який хімічний зв’язок називають ковалентним? Як можна пояснити направленість і насичуваність ковалентного зв’язку?
Які ковалентні зв’язки називаються,
 -
і
-
і -
зв’язками? Який метод валентних
зв’язків пояснює будову молекули
кисню?
-
зв’язками? Який метод валентних
зв’язків пояснює будову молекули
кисню?Який ковалентний зв’язок називається полярним? Що слугує кількісною мірою полярного ковалентного зв’язку? Користуючись таблицею Менделєєва визначте, який із зв’язків найбільш полярний: а/ О-Н б/ O-CL в/ O-Br г/ O-I/
Який механізм утворення ковалентного зв’язку називається донорно-акцепторним? Розгляньте утворення складних іонів NH4+ і BF-4.
Що таке гібридизація атомних орбіталей? Яке просторове розташування відносно центрального атому гібридних орбіталей sp, sp2,sp3?
Який хімічний зв’язок називається іонним і як він утворюється? В чому проявляється ненаправленість і ненасичуваність іонного зв’язку? Вкажіть молекулу, в якій частка іонного зв’язку максимальна: a/ KCl б/ CaCl2 в/ CaCl3; GeCl4.
В чому відмінність іонного зв’язку від ковалентного? Наведіть по одному прикладу сполук з ковалентним неполярним, ковалентним полярним і іонним зв’язками. В якій із молекул частка ковалентного зв’язку максимальна, а іонного мінімальна: a/ NaH, б/ AlH3, в/ PH3?
Який хімічний зв’язок здійснюється в металах? Як він утворюється? Чи характеризується направленістю хімічний зв’язок, який виникає в металах?
Які фізичні властивості металів обумовлені металічним хімічним зв’язком? Відповідь поясніть.
Вкажіть центральний іон-комплексоутворювач і назвіть комплексні сполуки: a/
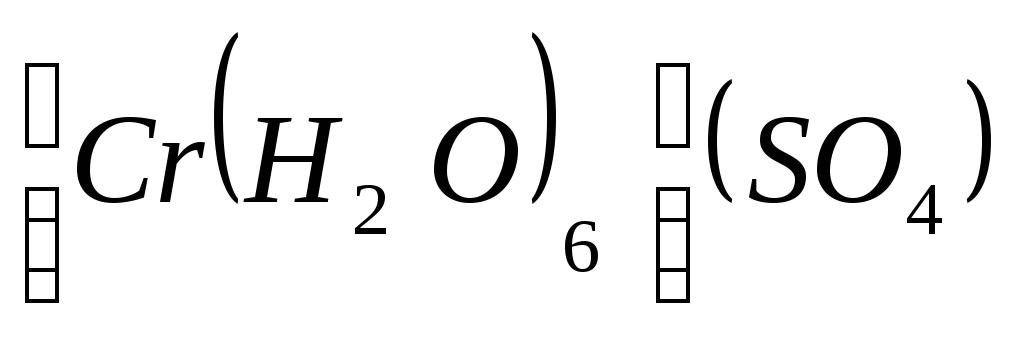 ;
б/
;
б/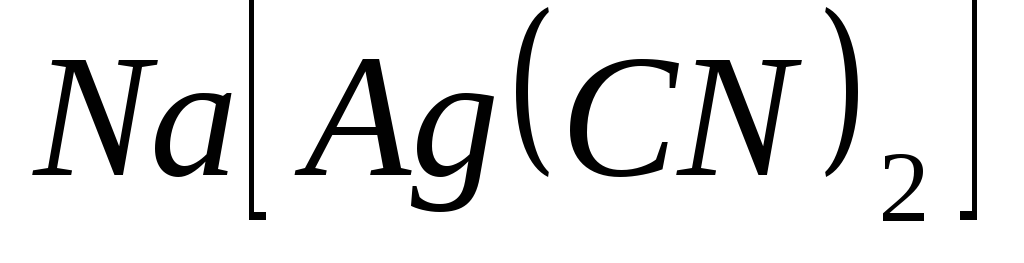 ;
в/
;
в/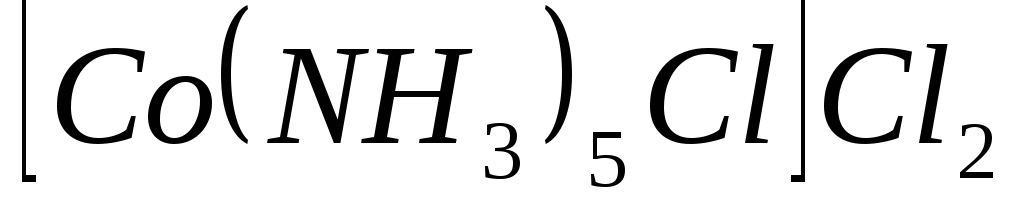 .
.У сполуці
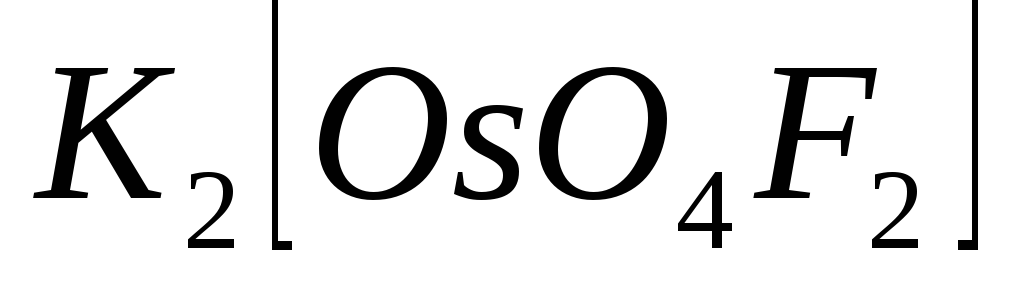 вкажіть: а/ комплексноутворювач, б/
координаційне число в/ ліганди. Назвіть
комплексну сіль.
, ,<,,
вкажіть: а/ комплексноутворювач, б/
координаційне число в/ ліганди. Назвіть
комплексну сіль.
, ,<,,
МОДУЛЬ 2.
