
Belozerov_V_N_Kuzina_Yu_A
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ОБНИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ АТОМНОЙ ЭНЕРГЕТИКИ (ИАТЭ)
Физико-энергетический факультет
В.И.БЕЛОЗЕРОВ, Ю.А.КУЗИНА
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
по курсу «Техническая термодинамика»
Обнинск 2005
УДК 621.1.0167(075.8)
Белозеров В.И., Кузина Ю.А. Лабораторный практикум по курсу «Техническая термодинамика». – Обнинск: ИАТЭ, 2005. – 60 с.
Данный лабораторный практикум предназначен для студентов специальностей 10.10.00 «Атомные электростанции и установки» и 07.05.00 «Ядерные реакторы и энергетические установки».
Содержит описание лабораторных работ по курсу «Техническая термодинамика». В пособии рассматриваются постановки задач, краткая теория, экспериментальные установки, методики проведения экспериментов, расчетная часть.
При выборе лабораторных работ учитывался опыт и некоторые материалы МЭИ.
Рецензенты: д.т.н. А.В.Жуков к.т.н. Г.К.Игнатенко
Темплан 2005, поз. 33
©Обнинский государственный технический университет атомной энергетики, 2005 г.
©В.И. Белозеров, Ю.А.Кузина, 2005г.
2
РАБОТА №1. ОПРЕДЕЛЕНИЕ ИЗОБАРНОЙ ТЕПЛОЕМКОСТИ ВОЗДУХА ПРИ АТМОСФЕРНОМ ДАВЛЕНИИ
Общие замечания
Теплоемкостью тела называется количество тепла, необходимое для нагрева вещества на один градус. Теплоемкость единицы количества вещества называют удельной теплоемкостью. Различают массовую теплоемкость c (кДж/кг град), объемную с' (кДж/м³ град) и мольную µс (кДж/кмоль град).
Теплоемкость изменяется с изменением температуры; иногда эта зависимость может быть значительной, поэтому теплоемкость, определяемая соотношением
с |
= |
|
q1−2 |
, |
(1) |
|
|
|
|
||||
|
m |
t2 −t1 |
|
|||
|
|
|
||||
называется средней теплоемкостью, а соотношение |
|
|||||
|
с = |
dq |
|
(2) |
||
|
dt |
|||||
истинной теплоемкостью, откуда |
|
|
||||
|
|
|
|
|
||
|
|
|
t2 |
|
||
|
q1−2 |
= ∫cdt . |
(3) |
|||
|
|
|
t1 |
|
||
Количество тепла, необходимое для нагрева тела на один гра-
дус, зависит от вида процесса, поэтому |
|
|||
сx = |
dqx |
, |
(4) |
|
dt |
||||
|
|
|
||
гдеx – параметр, которыйсохраняетсяпостояннымвданномпроцессе. Величинусp называют изобарнойтеплоемкостью, асv – изохорной. Уравнения связи между теплоемкостями имеют вид
с' =с ρ ; с = |
µс |
; с' = |
µс |
, |
(5) |
|
µ |
22.4 |
|||||
|
|
|
|
где µ – молекулярная масса; 22,4 – объем одного киломоля иде-
ального газа при нормальных условиях (Р =760 мм рт. ст., t = 0°С); ρ – плотность при нормальных условиях.
3
Основными методами измерения теплоемкости жидкостей и газов являются метод нагревания отдельной порции вещества и метод протока. Наиболее часто применяется метод протока.
Проточный калориметр
Исследование тепловых свойств газов и паров проводят в проточных калориметрах. Схема такого калориметра представлена на рис.1.
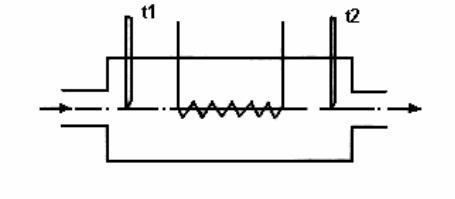
Исследуемое вещество непрерывно и с постоянным расходом протекает через калориметр. При входе в калориметр измеряется
его температура t1 ,
Рис.1. Схема проточного калориметра далее нагревателем подводится тепло Q, после этого измеряется температура t2 . Чтобы
получить формулы для расчета опытных результатов исследований в проточном калориметре, необходимо воспользоваться уровнем первого начала термодинамики для потока, отнесенным к 1 кг вещества:
q1−2 = h2 −h1 + |
w2 |
− w2 |
+ g(z2 − z1 ) + Aтехн , |
(6) |
2 |
1 |
|||
|
2 |
|||
|
|
|
|
где q – подведенное тепло, кДж/кг; h – энтальпия вещества, кДж/кг;
w2 |
– кинетическая энергия, кДж/кг; gh |
– потенциальная энергия, |
|
2 |
|||
|
|
кДж/кг; Aтехн – техническая работа в потоке, кДж/кг.
Поскольку техническая работа в калориметре не совершается, скорости газа w1 и w2 мало отличаются и разность потенциальных энергий незначительна, то уравнение (6) приводится к виду
q = h −h |
или |
Q |
= h |
−h , |
(7) |
|
|
||||||
2 |
1 |
|
G |
2 |
1 |
|
|
|
|
|
|
|
|
где G – расход вещества, кг/с; Q – подводимое тепло, кДж/с. Таким образом, подведенная в потоке теплота равна разности эн-
тальпий этого вещества. Следует отметить, что теплота Q, подведенная к протекающему через калориметр веществу, меньше, чем полное ко-
4
личество теплоты Qэл , выделенное нагревателем, на величину тепловыхпотерь Qтп . Сучетомэтихпотерьуравнение(7) запишетсяввиде
h |
−h |
= |
Qэл −Qтп |
. |
(8) |
|
|||||
2 |
1 |
|
G |
|
|
|
|
|
|
||
Энтальпия реального газа зависит от температуры и давления. Дифференциал энтальпии имеет вид
|
∂h |
|
∂h |
dp . |
(9) |
dh = |
|
dt + |
|
||
|
∂t p |
|
∂p t |
|
|
Поскольку воздух при атмосферном давлении по своим свойствам близок к идеальному газу, можно принять, что энтальпия от давления не зависит:
|
∂h |
|
= 0 . |
|
|
||
|
∂p |
t |
|
Тогда уравнение (9) запишется в виде
|
∂h |
(10) |
dh = |
dt = сp dt . |
|
|
∂t p |
|
Используя понятие о средней теплоемкости, имеем |
|
|
h2 −h1 = сpm (t2 −t1 ) , |
(11) |
|
где cpm – средняя изобарная теплоемкость в данном интервале
температур. Подставляя (11) в уравнение (8), получаем основную расчетную формулу
сpm = |
Qэл −Qтп |
. |
(12) |
|
|||
|
G(t2 −t1 ) |
|
|
Экспериментальная установка
Измерение теплоемкости воздуха производится в стеклянном проточном калориметре 2. Для уменьшения тепловых потерь в окружающую среду калориметр окружен стеклянной оболочкой 1, причем пространство между калориметром и оболочкой вакуумировано. В калориметре находится электрический нагреватель, с помощью которого тепло подводится к исследуемому воздуху. Мощность нагревателя регулируется автотрансформатором 8 и измеряется ваттметром 7.
5
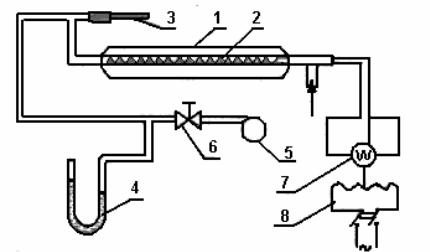
Расход воздуха через калориметр определяется перепадом давления, который создается воздуходувкой 5 и измеряется U-образ- ным манометром 4. По тарировочному графику (рис.2,3) определяется расход воздуха, который регулируется вентилем 6. Температура воздуха на выходе измеряется термопарой 3.
Рис. 2. Схема установки для измерения воздуха
Методика проведения измерений
1. Включить воздуходувку и вентилем установить расход воздуха, соответствующий перепаду давления около 200мм в.ст. Через 8–10 мин сделать запись температуры воздуха на выходе, причем она должна быть равной комнатной t1 . В дальнейшем принять ее за
температуру воздуха на входе.
2. Включить нагреватель калориметра, установив требуемую мощность латром (40 дел.). Регулируя мощность нагревателя, получить повышение температуры воздуха относительно t1 на 5–10 °С.
3.При установлении стационарного режима (постоянство температуры на выходе) записать показания всех приборов трижды, через 5 мин.
4.Изменить расход воздуха, уменьшив перепад давления примерно до 100 мм в.ст.
5.Электрическую мощность нагревателя отрегулировать таким образом, чтобы температура на выходе была такой же, как и в первом режиме.
6
6.Добиться стационарности температурного режима и провести все измерения для второго режима.
7.Отключить нагреватель. После того как термометр покажет комнатную температуру, выключить воздуходувку.
Обработка результатов измерений
По величинам, измеренным в опыте, нужно рассчитать среднюю изобарную теплоемкость воздуха cpm для интервала температур от
t1 до t2 . Необходимо учесть, что из-за малости тепловых потерь
все выделенное нагревателем тепло идет на нагревание воздуха, а также, что в данной установке измеряется не массовой расход, а объемный. Поэтому расчетная формула имеет вид
|
с'pm = |
|
|
|
Qэл |
|
|
|
, |
(13) |
||
|
V0 |
(t2 −t1 ) |
||||||||||
|
|
|
|
|
||||||||
где Qэл |
– мощность нагревателя, кВт; t2 |
и t1 – температура воздуха на |
||||||||||
выходе и входе в калориметр, °С; V0 – объемный расход воздуха, при- |
||||||||||||
веденный к нормальным условиям (T0 = 273,15 К и P0 |
= 760 мм рт.ст.), |
|||||||||||
м3/сек; |
с'pm – средняяобъемнаяизобарнаятеплоемкость, кДж/(м³/°С). |
|||||||||||
Величину с'pm можно вычислить по формуле |
|
|||||||||||
|
|
PV |
= |
PV |
|
|
||||||
|
|
0 0 |
|
t |
t |
, |
|
(14) |
||||
|
T |
T |
|
|
||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
0 |
|
|
t |
|
|
|
|
|
|
где Pt |
– атмосферное давление воздуха во время опыта, мм рт.ст; |
|||||||||||
Tt – температура воздуха в лаборатории, К; Vt – объемный расход
воздуха через калориметр, м³/с (определяется по рис.3).
По полученному значению средней объемной теплоемкости необходимо рассчитать величину средней массовой теплоемкости cpm :
|
с' |
22.4 |
|
|
сpm = |
pm |
|
, |
(15) |
|
µ |
|||
|
|
|
|
где µ – молекулярная масса, кг/кмоль; 22,4 – объем одного моля при нормальных условиях, м³/кмоль.
7
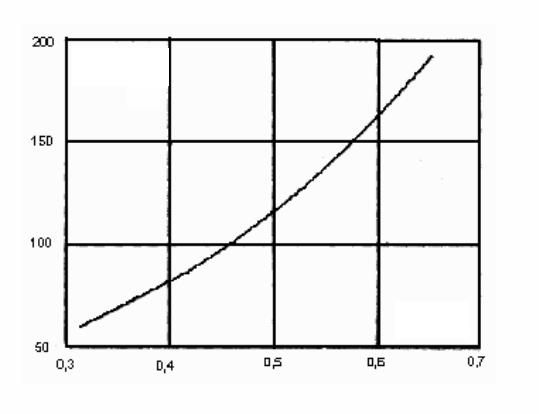
∆P, мм в.ст.
G, л/с
Рис.3. Зависимость расхода воздуха от перепада давлении
Кроме того, необходимо рассчитать среднюю изохорную теплоемкость воздуха cvm . Поскольку воздух по своим свойствам весьма
близок к идеальному газу, то связь между теплоемкостями выражается формулой Майера
сpm = сvm + R , |
(16) |
где R – газовая постоянная воздуха, кДж/кг °С.
По известным значениям теплоемкостей вычислить показатель
адиабаты |
|
k = сpm / сvm . |
(17) |
На основе полученных экспериментальных данных вычислить энтальпию и внутреннюю энергию при температуре t2 . Если начало отсчета энтальпии, т.е. h = 0, принять при температуре t = 0°C, то значение энтальпии идеального газа можно вычислить по формуле
t2 |
|
h = ∫сp dt = сpm t2 . |
(18) |
0 |
|
8
Необходимо определить, при какой температуре будет находиться начало отсчета внутренней энергии воздуха. Для этого нужно воспользоваться условием
u = h − RT = сpm t − R(t + 273.15) = 0 . |
(19) |
Затем вычислить значение внутренней энергии воздуха при температуре t2 .
Оценка точности экспериментальных данных
Максимально возможная относительная ошибка в значении теплоемкости с'pm составит
δС |
' |
= δQ |
+δV |
+δ(t |
|
−t ) + |
1 |
|
∂с'pm |
|
∆T . |
(20) |
|
pm |
2 |
|
|
|
|
||||||||
с' |
∂T |
||||||||||||
|
эл |
0 |
|
1 |
|
|
|
|
|||||
|
|
|
|
|
|
|
pm |
|
p |
|
|
||
Полученные значения изобарной и изохорной теплоемкостей следует сравнить с их табличными значениями. Величины их расхождений сопоставить с максимально возможной ошибкой эксперимента.
Замечание. Если существуют потери тепла от калориметра в окружающую среду, необходимо в уравнении (13) учестьQmn .
Контрольные вопросы
1.Определение теплоемкости.
2.Вывод изобарной и изохорной теплоемкостей.
3.Массовая, объемная и мольная теплоемкости, их связь.
4.Истинная и средняя теплоемкости.
5.Определение теплоемкостей по молекулярно-кинетической теории.
6.Уравнение Майера.
7.Уравнение теплового баланса.
9
РАБОТА №2. ИССЛЕДОВАНИЕ СЖИМАЕМОСТИ РЕАЛЬНЫХ ГАЗОВ ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
Общие замечания
Основные термические параметры p , υ и T характеризуют со-
стояние вещества. Связь между параметрами состояния можно выразить аналитически с помощью уравнения состояния, а также графически путем построения термодинамических диаграмм.
Простейшим уравнением реального газа, полученным на основе, главным образом, умозрительных качественных заключений, является уравнение Ван-дер-Ваальса, которое для 1 кг газа имеет вид
|
( p + |
|
|
|
a |
)(υ−b) = RT , |
(1) |
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
υ2 |
|
|
|
|
a, b – |
|
||||||
где R – газовая постоянная вещества; |
|
константы, опреде- |
||||||||||||||||
ляемые с помощью уравнений |
|
|
|
|
|
|
|
|
|
|
||||||||
|
∂p кр |
= 0 , |
|
∂2 p |
кр |
= 0 , |
(2) |
|||||||||||
|
|
|
|
|
|
∂υ |
2 |
|
|
|||||||||
|
∂υ T |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
справедливых для критической точки. |
|
|
|
|
|
|
|
|
||||||||||
Отсюда нетрудно получить |
|
|
|
|
|
|
|
|
|
|
||||||||
a = |
2T |
|
|
R2T 2 |
, b = |
1 |
|
|
RT |
|
||||||||
|
|
|
|
к |
|
|
|
к |
. |
(3) |
||||||||
64 |
|
|
p |
8 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
p |
|
||||||
|
|
|
|
|
|
|
|
к |
|
|
|
|
|
|
|
к |
|
|
Изотермы ван-дер-ваальсовского газа в p , υ-диаграмме имеют вид, изображенный на рис.1. При T <Tк изотермы имеют волнооб-
разный участок, соответствующий фазовому переходу «жидкостьпар». Длина этого участка уменьшается с повышением температуры, и при температуре ( T =Tк ) максимум и минимум волнообраз-
ного участка совпадают. Что касается волнообразного участка кри-
вой, то поскольку на этом участке |
∂p |
> 0 , он соответствует фи- |
|
||
|
∂υ T |
|
зически нереализуемым состояниям и лишен физического смысла. Практически фазовые переходы начинаются раньше, и реальные изотермы представляют собой горизонтальные линии (а–в). Изо-
10
