
Belozerov_V_N_Kuzina_Yu_A
.pdfСистематическую составляющую погрешности рассчитывают по формуле
∆c = |
c −c0 |
100 , |
(20) |
|
|||
|
c0 |
|
|
где c0 – значение теплоемкости образцовой меры (по свидетельст-
ву) в Дж/(кг К).
Определение предела допускаемой погрешности проводят по формуле
∆ = ∆c ± ∆° . |
(21) |
Контрольные вопросы
1.Теплоемкость твердых тел.
2.Закон Дюлонга и Пти.
3.Размерность µ.
4.Уравнение Дебая.
5.Области использования закона Дюлонга и Пти и уравнения Дебая.
РАБОТА № 7. ИЗУЧЕНИЕ ПОЛИТРОПНЫХ ПРОЦЕССОВ В ГАЗАХ
Общие замечания
Политропными называются обратимые термодинамические процессы, удовлетворяющие уравнению
Pυn = const , |
(1) |
где υ – удельный объем; n – показатель политропы, изменяющийся для различных процессов от 0 до ±∞. Для одного и того же процесса показатель политропы – величина постоянная. Понятие «политропный процесс» обобщает все известные термодинамические процессы. Нетрудно убедиться в том, что изобарный, изохорный, изотермический и адиабатный процессы являются частными случаями политропного процесса. С этой целью рассмотрим уравнение (1) при некоторых значениях показателя политропы n:
–при n = 0 P = const – изобарный процесс;
–при n = 1 Pυ = const – изотермический процесс;
41
–n = k, Pυk =const – адиабатный процесс ( k =cP / cυ );
–при n = ±∞ P1/ ±∞υ=const – изохорный процесс.
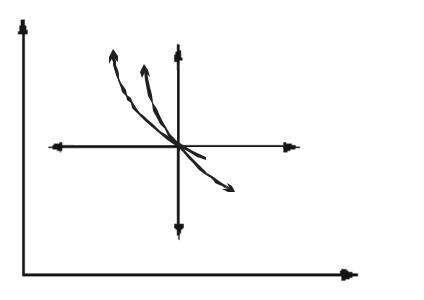
Уравнение политропного процесса по внешнему виду схоже с уравнением адиабатного процесса. Основное различие в этих процессах заключается в том, что показатель адиабаты (изоэнтропы) k является в общем случае величиной переменной, в то время как показатель политропы n остается величиной постоянной. Изобразим политропные процессы в P, υ-координатах при различных по-
казателях политропы n (рис.1). Как видно из рис. 1, адиабата делит все термодинамические процессы в P, υ-координатах на две группы, различающиеся тем, что подводится в них тепло или отводится.
p
n=0 – изобара
 n=1 – изотерма n=k – адиабата
n=1 – изотерма n=k – адиабата
n=±∞ – изохора
Рис. 1. Политропный процесс в P, υ- координатах
1. Группа процессов, расположенных выше адиабаты. Основной особенностью этих процессов является то, что в них
тепло подводится к системе.
2. Группа процессов, расположенных ниже адиабаты. В этой группе процессов тепло отводится от системы.
Решая совместно уравнение (1) и уравнения состояния идеального газа, можно получить зависимости между основными термодинамическими параметрами в политропном процессе:
P1 |
|
υ2 |
n |
T2 |
|
υ1 |
n−1 |
|
T2 |
|
P2 |
|
n−1 |
|
|||
|
n |
|
|
||||||||||||||
= |
|
, |
= |
|
, |
= |
|
. |
(2) |
||||||||
P2 |
T1 |
|
T1 |
|
|||||||||||||
|
υ1 |
|
|
υ2 |
|
|
P1 |
|
|
|
|||||||
42
Работу расширения в политропном процессе можно рассчитать при помощи интеграла вида
l1−2 = ∫2 |
Pdυ . |
(3) |
1 |
|
|
Выполняя интегрирование (3) с учетом соотношений (2), можно получить связь работы расширения при политропном процессе с основными термодинамическими параметрами:
|
P1υ1 |
|
|
|
P2 |
|
n−1 |
|
|
P1υ1 |
|
|
|
υ1 |
|
n−1 |
|
|
|
|
n |
|
|
|
|||||||||||||
l = |
|
|
|
|
, l = |
|
|
|
||||||||||
|
− |
|
|
|
− |
|
|
(4) |
||||||||||
n −1 |
1 |
P |
|
|
n −1 |
1 |
υ |
|
|
|||||||||
|
|
|
|
|
|
|
|
2 |
|
|
||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поскольку рабочим телом в политропном процессе является идеальный газ, то соотношения (4) могут быть переписаны следующим образом:
|
R |
|
|
RT1 |
|
|
P2 |
|
n−1 |
|
|
||
l = |
(T2 |
−T1 ) , l = |
|
n |
|
|
|||||||
|
|
|
|
1 |
− |
|
|
|
|
, |
|||
n −1 |
|
n −1 |
P |
|
|||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT1 |
|
|
|
υ1 |
|
n−1 |
|
1 |
|
|
|
|
|
l = |
|
|
|
, l = |
|
(P1υ1 |
− P2υ2 ) . |
|
||||||
|
− |
|
|
|
|
(5) |
||||||||
n −1 |
1 |
υ |
|
|
n −1 |
|||||||||
|
|
|
2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Удельная теплоемкость политропного процесса определяется по соотношению
c |
= c |
n −k |
. |
(6) |
|
||||
n |
V |
n −1 |
|
|
Если известна удельная теплоемкость политропного процесса, то количество теплоты, подведенное к рабочему телу в этом процессе, определяется как
q = ∫2 cn dT .
1
Подставив (6) в последнее уравнение и проинтегрировав его, получим
q |
= c |
n −k |
(T |
−T ) . |
(7) |
|
n −1 |
||||||
1−2 |
V |
2 |
1 |
|
43

Из уравнения (7) следует, что теплота, подведенная к рабочему телу в политропном процессе, в общем случае расходуется как на изменение внутренней энергии, так и на совершениевнешней работы.
Изменение энтропии в политропном процессе определяется с помощью уравнения
∆S |
= S |
|
− S |
= c |
|
n −k |
ln |
T2 |
|
|
|
|||||
|
|
n −1 |
T |
|||||||||||||
|
|
|
2 |
1 |
|
V |
|
|
||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
υ1 |
|
|
|
n −k |
|
|
P2 |
|
|||
∆S = c |
|
(n − k)ln |
|
= c |
ln |
. |
||||||||||
|
|
|
|
|||||||||||||
V |
|
|
|
|
υ2 |
|
V |
n |
|
|
|
P1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Для того, чтобы определить значение показателя политропы того или иного газового процесса, необходимо располагать экспериментальными данными (например, температурой и давлением) в начальной, промежуточных и конечной точках этого процесса. Ло-
гарифмируя уравнение политропы P1υn1 = P2υn2 , получаем
n = ln(P1 / P2 ) . ln(υ2 / υ1 )
Построив по имеющимся экспериментальным данным конкретного политропного процесса график зависимости давления от удельного объема в логарифмических координатах ln(P) −ln(υ)
(рис.2), можно найти величину показателя политропы n для этого процесса. Поскольку кривая процесса в этих координатах становится прямой линией, то n представляет собой тангенс угла наклона этой линии в диаграмме ln(P) −ln(υ) .
Если в логарифмических координатах кривая политропного процесса остается нелинейной, то её следует разбить на ряд линейных участков (т.е. заменить непрерывную нелинейную функцию на кусочно-непрерывную функцию таким образом, чтобы на отдельных участках она была линейной) и вычислить на каждом из этих участков значение показателя политропы n, а затем рассчитать среднее для процесса значение.
44
|
|
ln( p ) |
|
|
|
|
ln( p1 ) |
1 |
|
|
|
ln( p2 ) |
|
|
2 |
||
ln( υ)
ln( υ1 ) |
ln( |
υ2 ) |
|
|
|
Рис.2. График зависимости давления от удельного объема
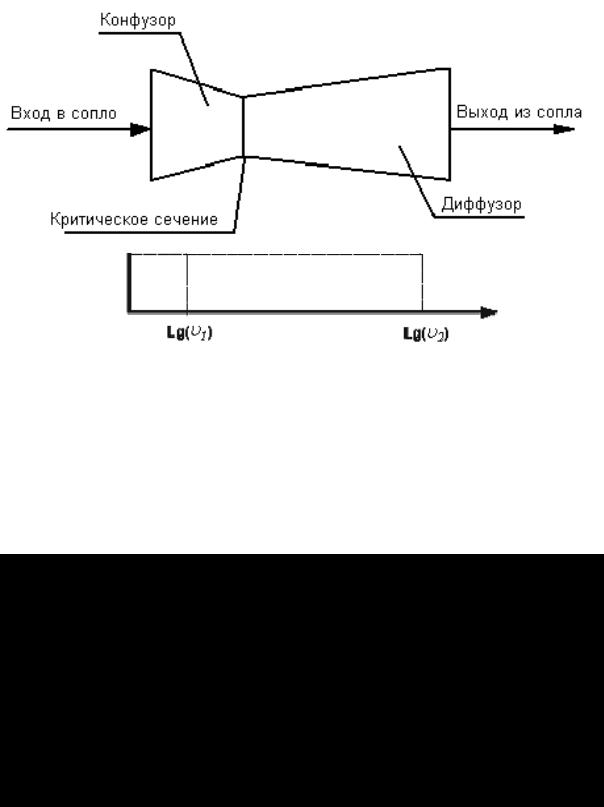
Для увеличения скорости потока часто используют специально спрофилированные каналы, называемые соплами. Сопло обычно состоит из двух частей: диффузора – расширяющегося канала и конфузора – сужающегося канала (рис. 3). В настоящей работе исследуется процесс истечения только из суживающейся части, т.е. изконфузора.
Рис. 3. Сопло Лаваля
45
Запишем уравнение первого начала термодинамики в предположении, что поток находится на одной нивелирной высоте и не совершает технической работы, тогда
dq1−2 = dh + wdw , |
(8) |
где q – подведенная теплота, кДж/кг; h – энтальпия газа, кДж/кг;
w – скорость газа, м/с. Это уравнение показывает, что тепло, подводимое к потоку или отводимое от него, расходуется на изменение энтальпии и скорости.
Рассмотрим случай, когда dq1−2 = 0 , т.е. адиабатическое истече-
ние из конфузора при n = k. Для этого случая уравнение (8) перепишется в виде
dh + wdw = 0 . |
(9) |
Откуда видно, что если адиабатный поток ускоряется ( dw > 0 ), то его энтальпия уменьшается ( dh < 0 ), и наоборот. Интегрируя (9), получаем
− = w2 − w2
h1 h3 3 2 1
или, пренебрегая дефектом кинетической энергии,
w3 = 2(h1 −h3 ) . |
(10) |
Здесь h1 , h3 – энтальпия газа на входе и выходе из сопла, кДж/кг.
В предположении, что воздух по своим свойствам близок к идеальному газу, (10) можно переписать в виде
w3 = 2cp (T1 −T3 ) . |
(11) |
Массовый расход газа через сопло можно рассчитать по формуле
G = w3 f3 /V3 [кг/с].
Здесь f3 – площадь сопла на выходе; V3 – удельный объем на
выходе из сопла, определяемый из уравнения состояния идеального газа Менделеева-Клапейрона.
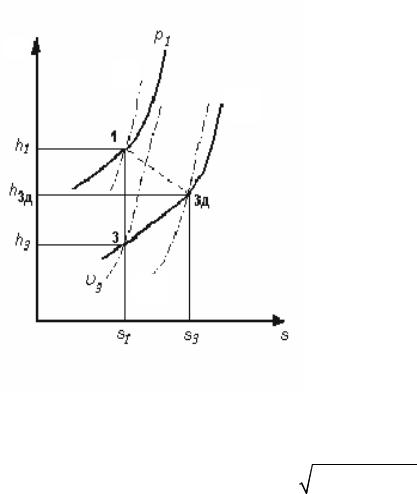
При наличии трения часть динамического перепада давления затрачивается на его преодоление, поэтому действительная скорость истечения воздуха меньше теоретической, рассчитанной по формулам (10) или (11). Из рис. 4 видно, что точки 3 и 3д лежат на разных изобарах, и положение, а следовательно, и параметры точки 3д заранее не известны.
46
h |
p1 |
|
|
|
|
|
|
|
υ1 |
|
|
|
|
p3д |
|
|
||
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
h1 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h3д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3д |
|
|
|
|||||||||||
h3 |
|
|
3 |
|
|
|
υ |
|
|
|
|
|
|
|||
|
|
|
3д |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
υ3 |
|
|
|
|
|
|
||||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
s1 |
|
s3д |
|
s |
|||
Рис.4. Процесс истечения с трением
Для нахождения действительной скорости истечения из сопла, действительного удельного объема и температуры можно воспользоваться методом последовательных приближений. Необходимость применения этого метода обусловлена нелинейной зависимостью действительной температуры от действительной скорости истечения. Исходная система уравнений имеет вид
G3д = w3 f3 / υ3 |
|
|
|
= 2cp (T1 −T3д ) |
(12) |
w3д |
||
|
= RT3д / P3 |
|
υ3д |
|
|
|
|
|
Здесь T3д, V3д, w3д – действительная температура, удельный объ-
ем и скорость истечения на выходе из сопла соответственно. Решение системы взаимосвязанных уравнений (12) следует проводить следующим образом.
1. Задать начальное значение действительной температуры T3д
на выходе из сопла. Обычно ее берут на 2–4 К выше теоретической температуры истечения T3 .
2.Из первого и второго уравнений системы (12) вычисляют действительную скорость истечения и удельный объем.
3.Из третьего уравнения системы (12) вычисляют новое значение действительной температуры.
4.Находят относительную ошибку ε в определении температу-
ры истечения по формуле
47
|
|
T (i) −T (i−1) |
|
|
|
ε = |
|
3д 3д |
|
100% , |
|
T (i) |
|||||
|
|
|
|
||
|
|
3д |
|
|
где i – число замеров.
Если величина относительной ошибки ε не превосходит 3%, то расчет оканчивают. В противном случае возвращаются к пункту 2, используя в качестве начального приближения для температуры истечения значение T3д , полученное на предыдущем шаге расчета.
Зная величины теоретических и действительных значений массовых расходов и скоростей истечения, можно определить коэффициенты расхода µ и скорости φ, если воспользоваться формулами
μ = G3д /G , φ= w3д /w3 .
Описание установки
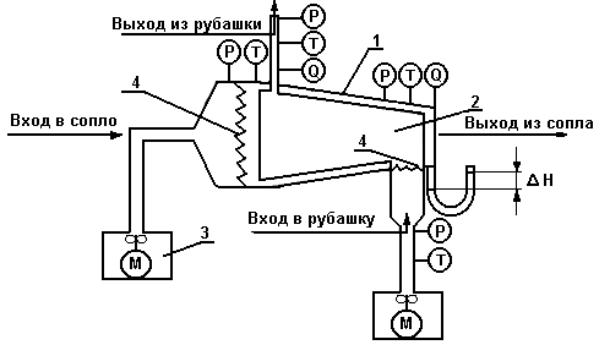
На рис. 5 представлена принципиальная схема экспериментальной установки. Рабочий участок представляет собой суживающееся сопло, на входе которого установлен воздушный фильтр, предохраняющий внутреннюю поверхность сопла от загрязнения. Динамический напор в сопле создается воздуходувкой 3.
Рис. 5. Принципиальная схема установки: 1 – сопло; 2– охлаждающая рубашка; 3 – вентилятор; 4 – нагреватель
48
Измерение давления и температуры производится на входе, в средней части сопла и на выходе. С этой целью по длине суживающегося сопла на входе, в средней части и на выходе имеются отборы для измерения статического давления Pвх, Pср, Pвых и температуры
T1, T2 , T3 соответственно. Статическое давление измеряется с по-
мощью U-образных манометров в точках «ВХОД», «СЕРЕДИНА» и «ВЫХОД». Для измерения температур применяются полупроводниковые диоды КД522. Электрический сигнал с диодов выводится на цифровой индикатор. Измерение температуры в различных точках сопла осуществляется с помощью переключателя «T1, T2 , T3 ».
На выходе из сопла производится измерение давления при помощи трубки Пито-Прандтля и U-образного манометра «РАСХОД СОПЛО». Используя приведенный на передней стенке установки график зависимости давленияPРС = PРС (Q, л/с) , можно определить
расход воздуха через сопло.
Порядок проведения опыта
1.Перед началом работы необходимо измерить давление и температуру окружающей среды барометром и термометром.
2.Включить тумблеры «Сеть 220» и «Компрессор сопла». Ручкой «Напряжение компрессора сопла» установить расход, соответствующий перепаду давления по U-образному манометру 30 мм.
3.После установления стационарного режима, который характеризуется постоянством давления и температуры, провести измерения действительного расхода воздуха, давлений и температур в потоке воздуха на входе, в середине и на выходе из сопла.
4.Повторить измерения по пункту 3, установив расход, соответствующий перепаду давления по U-образному манометру 50 мм.
5.Включить тумблер «Нагреватель сопла» и ручкой «Нагреватель сопла» довести температуру воздуха на входе в сопло до 50 °С при расходе, соответствующем перепаду давления на U-образном манометре 30 мм.
6.Повторить измерения с температурой воздуха на входе в сопло до 50 °С при расходе, соответствующем перепаду давления на U-образном манометре 50 мм.
7.Результаты измерений занести в таблицу.
49
Таблица измеренных величин TВХ = комнатной температуре
|
Режим |
|
PВХ |
|
PСР |
PВЫХ |
T1 |
T2 |
T3 |
||
|
30 мм |
|
|
|
|
|
|
|
|
|
|
|
50 мм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TВХ = 50°С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Режим |
PВХ |
|
PСР |
PВЫХ |
T1 |
T2 |
|
T3 |
|
|
|
30 мм |
|
|
|
|
|
|
|
|
|
|
|
50 мм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обработка результатов измерений
1.Используя полученные данные, вычислить удельный объем воздуха на входе, выходе и середине сопла.
2.Определить объемный расход воздуха во всех трех точках сопла и массовый расход на выходе.
3.Построить кривую процесса в логарифмических P, υ-коорди-
натах и определить показатель политропы.
4.Используя уравнение политропного процесса, рассчитать величину показателя политропы и сравнить с его значением, найденным из графика.
5.Рассчитать работу расширения L , изменение внутренней энергии ∆U и изменение энтропии ∆S .
6.Определить теоретическую скорость истечения.
7.Используя метод последовательных приближений, определить действительную температуру, скорость истечения и сравнить
сих теоретическими значениями.
8.Определить коэффициент расхода и коэффициент скорости. Расчеты выполнить для каждого из режимов истечения.
Контрольные вопросы
1.Основные термодинамические процессы.
2.Связь температур и давлений в политропном процессе.
3.Изменение энтропии в процессах.
4.Количество подведенного (отведенного) тепла. Совершение работы. Изменение внутренней энергии в процессах.
5.Адиабатное истечение из насадок.
50
