
Belozerov_V_N_Kuzina_Yu_A
.pdf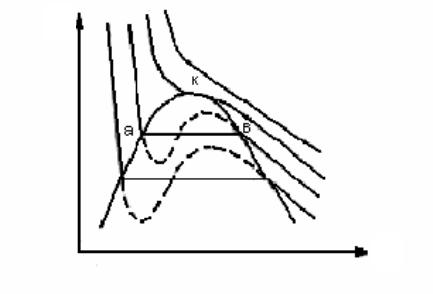
терма, проходящая через точку К, определяет критическую температуру. При температурах выше критической изотермы имеют вид плавных кривых. Изотерма, проходящая через точку К, определяет критическую температуру. При температурах выше критической изотермы имеют вид плавных кривых. Экспериментально можно получить зависимость между давлением и удельным объемом, производя сжатие реальных газов при постоянной температуре (опыты Т.Эндрюса). В настоящее время теоретически обоснованным является уравнение состояния, представляющее собой разложение коэффициента сжимаемости z в бесконечный ряд по степеням плотности 1/ υ :
z = pυ/ RT =1+ |
B |
+ |
C |
+ |
D |
+... , |
(4) |
υ |
2 |
3 |
|||||
|
|
υ |
υ |
|
|||
где B,C, D – вириальные коэффициенты.
p
υ
υ
Рис.1. Изотермы ван-дер-вальсовского газа
Возникают значительные трудности в вычислении этих коэффициентов из-за незнания точного закона взаимодействия молекул, поэтому используется полуэмпирическое уравнение состояния, коэффициенты которого вычисляются по экспериментальным данным, в виде
z = pυ/ RT =1+ B ' p +C ' p2 + D ' p3 +... |
(5) |
В настоящей работе в качестве рабочего вещества выбрана углекислота ( tкр = 31,05°С), что позволяет изучить закономерности
изменения состояния при изотермическом сжатии в области докритических и закритических температур и получить зависимости удельного объема от давления.
11
Описание экспериментальной установки
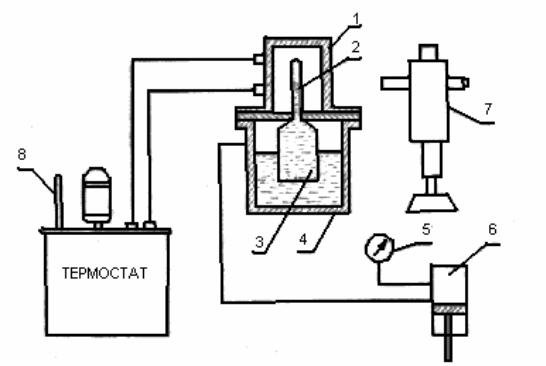
Схема экспериментальной установки приведена на рис.2. Углекислый газ находится в толстостенном капилляре 2. Снизу к капилляру припаяна стеклянная колба 3 с отверстием внизу, через которое поступает ртуть и сжимает находящийся в капилляре углекислый газ. Ртуть залита в стальной сосуд 4, рассчитанный на большое давление, причем уровень ртути всегда должен быть выше отверстия в колбе. Передача давления на ртуть осуществляется с помощью масла, которое заполняет пространство над ртутью в сосуде 4. Сжатие масла производится поршневым манометром 6. Давление масла, а следовательно, и давление углекислоты в капилляре измеряется образцовым манометром 5. Для обеспечения постоянства температуры углекислого газа во время опыта капилляр 2 помещен в резервуар 1 из оргстекла, через который термостатом TC-16A прокачивается вода. Заданная температура воды поддерживается путем включения нагревателя электрическим реле, срабатывающим от контактного термометра. При равновесном состоянии температура углекислого газа равна температуре, протекающей в резервуаре 1 воды. Температура воды в термостате измеряется ртутным термометром 8. Для измерения объема капилляра, занятого углекислым газом, применяется катетометр 7.
Рис. 2. Схема установки для изотермического сжатиям углекислоты
12
Методика проведения измерений
Опыт состоит в измерении давлений и удельных объемов углекислого газа, соответствующих ряду равновесных состояний при одинаковой температуре. Для полного представления о свойствах реальных газов опыт провести при 12, 20, 30 и 40°С (критические параметры углекислого газа: pк = 73,834 бар, tк = 31,05°C и
υк = 0,00214 м³/кг).
Нужный уровень температуры установить с помощью контактного термометра. Затем включить оба нагревателя и после достижения заданной температуры (срабатывает реле регулятора термостата) выключить нагреватель мощностью 700 Вт. Опыт проводится в следующем порядке.
1.Установить первый режим, для чего краном отрегулировать расход охлаждающей воды. Включить двигатель термостата.
2.Проверить правильность фокусировки катетометра по верхней части внутренней поверхности капилляра. Записать показания катетометра, которые в дальнейшем используются в качестве точки
начала отсчета и обозначаются через y0 .
3.Сжать поршневым компрессом углекислоту так, чтобы стал виден столбик ртути в капилляре.
4.При наступлении равновесного состояния (температура не изменяется в течение 10 мин) провести запись показания образцового манометра и положение столбика ртути в капилляре, измеренного с помощью катетометра в условных единицах y .
5.Измерения проводить через каждые 30 делений шкалы манометра, поддерживая давление постоянным в течение 2–3 мин. (время выравнивания температуры углекислоты в капилляре). Повышение давления производить плавно и во избежание поломки установки не поднимать давление выше 270 делений по манометру!
6.Закончив проведение первого цикла измерений, плавно снизить давление до первоначального. Закрыть кран подачи охлаждающей воды.
7.Включить нагреватели термостата. Контактным термометром установить следующий температурный режим. Повторить измерения по описанной выше методике.
13
Обработка результатов измерений
1. В работе измеряется лишь относительная величина изменения объема углекислоты (в условных единицах). Абсолютная величина удельного объема υ=V / G непосредственно из опыта не может быть получена, т.к. неизвестны ни размеры капилляра, ни количество углекислого газа G . Важно отметить, что количество углекислого газа, находящегося в капилляре, не изменяется в течение всех опытов. Определить численное значение удельного объема по выражению
υ= |
V |
= |
а l |
= k l , |
(6) |
|
G |
G |
|||||
|
|
|
|
где k и а – константы, l – длина капилляра, занятая углекислым газом, определяемая выражением l =y0 – y.
Постоянная k определяется по опытным данным. Для этого взять температуру и давление углекислого газa и, воспользовавшись таблицами термодинамических свойств СО2, определить величину удельного объема υтабл при этих параметрах, а затем найти
k по формуле
k =υтабл / l . |
(7) |
Расчет величины k провести по первым точкам нескольких изотерм и в дальнейшем использовать ее среднее значение.
После этого по уравнению (6) провести расчет υ для всех измеренных в опыте состояний.
2. По экспериментальным данным построить изотермы углекислого газа в p, υ-диаграмме и провести пограничные кривые по
данным опыта.
3.Для одной из температур, большей, чем критическая (например, для 40°С), для которой построена изотерма по опытным данным, построить изотерму идеального газа и сравнить их.
4.Для этой же температуры построить изотерму, рассчитанную по уравнению (1), представив его в виде
p = |
RT |
− |
a |
, |
(8) |
|
υ−b |
υ2 |
|||||
|
|
|
|
где a, b рассчитать по формулам (3).
14
Задаваясь значениями удельного объема υ, определить соответствующие им давления p . Для состояний, зафиксированных в
опыте при этой температуре, сравнить величин давления, измеренного в опыте и полученного расчетом по (8), и вычислить относительную величину расхождений между ними
δp = |
pэксп − pрасч |
100% . |
(9) |
|
5. Подобным образом построить изотерму, рассчитанную по (8) для температуры, меньшей, чем критическая (20°С). Нанести на p, υ-диаграмму изотерму t = 20°C по данным таблиц термодинами-
ческих свойств СО2 и сопоставить ее с изотермой, полученной по (8). 6. Полученные удельные объемы в данной работе позволяютвычислить значения второго вириального коэффициента для углекислого газа и составить простейшее уравнение состояния реального
газа (5) вида
|
|
|
|
|
|
|
|
|
|
|
z =1+ B ' p . |
(10) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Для этого по эксперименталь- |
|
z |
|
|
|
|
|
|
z=0 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
ным данным вычислить коэффи- |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
циент сжимаемости z = pυ/ RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
α |
|
|
|
|
|
|
|||
|
|
|
|
|
и построить изотермы в |
z, p -диа- |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
грамме, а затем экстраполировать |
||||
|
|
|
|
|
|
|
|
B′=tgα |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
их на нулевое давление, т.е. в |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
t=const |
|
|
|
|
|
|
|
||||
|
|
|
точкускоординатами p |
= 0, z =1. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Значение B ' при некоторой тем- |
|
|
|
|
|
|
|
|
|
|
|
|
p |
||
|
|
|
|
|
|
|
|
|
|
|
|
пературе может быть определено |
|
|
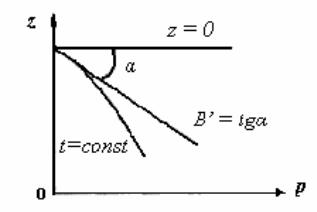
Рис. 3. Графический метод оп- |
||||||||||||
|
как тангенс угла наклона каса- |
||||||||||||
ределения B′ |
тельной к соответствующей изо- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
терме |
z, p -диаграммы в точке p = 0 . Для определения B ' |
восполь- |
|||||||||||
зоваться рис.3.
Определить зависимость B ' от температуры в аналитической форме
B ' = |
b1 |
− |
b2 |
. |
(11) |
T |
|
||||
|
|
T |
|
||
|
|
2 |
|
|
|
Коэффициенты b1 и b2 в (11) определить, выбрав из рассчитанных выше величин B ' два значения при определенных температурах.
15
7. Найти зависимость энтальпии газа от температуры и давления. Для этого воспользуемся уравнением (5) и дифференциальным уравнением для энтальпии
|
|
|
|
∂h |
|
|
= υ−T |
|
∂υ |
|
|
|
|
(12) |
|||||||||||||||
|
|
|
|
|
|
|
. |
|
|
||||||||||||||||||||
|
|
|
|
∂p |
|
T |
|
|
|
|
|
|
|
|
∂p |
|
p |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Поскольку |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
∂z |
|
|
|
|
|
p |
|
|
|
|
|
∂υ |
|
|
|
|
|
||||||||||||
|
|
|
|
|
= |
|
|
|
|
T |
|
|
|
|
|
|
|
−υ |
, |
(13) |
|||||||||
|
|
|
|
RT |
2 |
|
|
|
|
|
|
||||||||||||||||||
∂T |
p |
|
|
|
|
|
|
|
∂T p |
|
|
|
|
||||||||||||||||
то сравнивая с (12), получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
1 ∂z |
|
|
= − |
|
1 |
|
|
|
|
∂h |
|
, |
|
(14) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
∂T |
|
RT |
2 |
|
∂p |
|
||||||||||||||||||||
|
|
p |
p |
|
|
|
|
|
|
|
T |
|
|
|
|||||||||||||||
откуда для (10) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
∂h |
|
|
= −RT 2 |
|
dB ' |
. |
|
|
|
(15) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
∂p |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Интегрируя выражение (15), имеем |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
hT |
|
= hT |
|
− RT 2 |
dB ' |
p . |
|
|
(16) |
||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
p |
|
|
|
0 |
|
|
|
|
|
|
|
dT |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Используя выражение (11), получаем расчетную зависимость |
|||||||||||||||||||||||||||||
hT = hT − R(b |
− |
2b2 |
) p , |
|
|
(17) |
|||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||
|
|
p |
|
0 |
|
|
|
|
|
|
1 |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где hT – энтальпия газа при температуре T |
и давлении |
p ; hT – |
|||||||||||||||||||||||||||
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
||||
энтальпия газа в идеальном состоянии, взятая из табл. П.1.3. Вычисленные значения энтальпии сравнить с табличными.
Оценка точности экспериментальных данных
Максимальная возможная относительная ошибка в значении удельного объема υ составит
δυ = δυтабл +δl0 |
+δa +δl + |
|
1 |
|
∂υ |
∆T |
+ |
|
1 |
∂υ |
∆p |
, |
(18) |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|||||||||||||
|
|
|
υ |
∂T p |
|
|
|
υ |
∂p |
T |
|
|
||
где δυтабл – относительная ошибка табличных значений; δl0 |
– от- |
|||||||||||||
носительная ошибка измерения длины капилляра в состоянии, используемом для расчета k ; δa – относительная ошибка, обусловленная непостоянством сечения по длине капилляра.
16
РАБОТА №3. ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ МЕЖДУ ТЕРМИЧЕСКИМИ ПАРАМЕТРАМИ УГЛЕКИСЛОГО ГАЗА
Общие замечания
Для идеального газа связь между термическими параметрами описывается уравнением состояния Клайперона-Менделеева
pυ = RT , |
(1) |
где R = Rμ / μ –газовая постоянная, Rμ = 8314 Дж/кмоль |
град; |
υ =V / G –удельный объем газа, м³/кг; V –объем газа, м³; G – масса газа, кг.
Уравнение (1) получено в предположении, что между молекулами газа отсутствуют силы взаимодействия, и для описания поведения реальных газов применимо лишь в частном случае (газ при небольшом давлении вдали от области конденсации).
Вследствие межмолекулярного взаимодействия поведение реальных газов значительно отклоняется от предписываемого уравнением (1).
Уравнение состояния реальных газов, в основу которого были положены упрощенные представления о молекулярно-кинетичес- ких свойствах этих газов, получено Ван-дер-Ваальсом в 1873 г. Это уравнение имеет вид
( p − |
a |
)(υ−b) = RT |
, |
(2) |
|
||||
|
υ2 |
|
|
|
где a, b – постоянные, зависящие от природы газа.
Уравнение (2) можно представить в виде зависимости между безразмерными приведенными параметрами
(π+ |
3 |
)(3ϕ−1) =8τ , |
(3) |
|
ϕ2 |
||||
|
|
|
где ϕ = υ/ υкр, π = p / pкр, τ =T /Tкр .
Рассмотрим область газообразного и жидкого состояний вещества в p,T -диаграмме (см. рис.1).
Изохоры и линия фазового перехода «жидкость-пар» изображены на рис.1, а. Слева от линии насыщения находится область жидкости (изохоры υ< υкр ), справа – область газообразного состояния
17
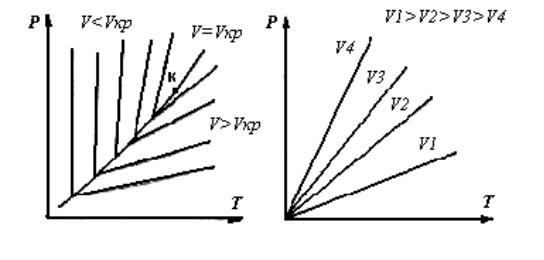
(изохоры υ> υкр ). Изохора, соответствующая удельному объему υ= υкр , называется критической изохорой. Диаграмма состояния в p,T -координатах реального вещества сильно отличается от диаграммы состояния идеального газа (рис. 1 а, б).
а) б)
Рис.1. Изохоры реального и идеального газов
Основным источником сведений о свойствах реальных газов является эксперимент. В настоящей работе экспериментальным путем получим зависимость между параметрами p,T для углекисло-
го газа вдоль нескольких изохор и определим удельный объем, соответствующий каждой изохоре.
Описание экспериментальной установки
Экспериментальное исследование термических свойств углекислого газа и определение удельного объема проводится методом пьезометра. Принципиальная схема установки, выполненной по методу пьезометра постоянного объема, показана на рис.2. Установка состоит из толстостенного сосуда высокого давления – пьезометра 1, изготовленного из нержавеющей стали. Пьезометр помещен в термостат 2, температурный режим которого регулируется нагревателями, управляемыми электрическим реле, которое срабатывает от контактного термометра 3. Температура углекислого газа определяется термометром, расположенным на термостате слева. Давление в пьезометре измеряется манометром 5, который подсоединяется к пьезометру через игольчатый вентиль 6. Для получения эксперимен-
18
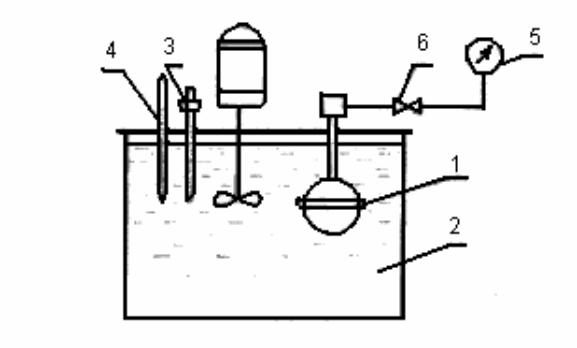
тальных данных при различных удельных объемах опыт проводится одновременно на двух пьезометрах. Объем первого пьезометра равен 41 см3, второго – 37 см3. По экспериментальным данным определяется масса углекислого газа, заключенного в каждом пьезометре.
Рис.2. Схема экспериментальной установки для исследования термических свойств углекислого газа
Методика проведения измерений
1.Включить двигатель термостата и, не включая нагреватель термостата, записать показания манометров при комнатной температуре.
2.Включить нагреватели термостата и установить указатель контактного термометра на нужное значение температуры. Измерения проводить от комнатной температуры до 90°С через каждые 10°.
3.При достижении требуемой температуры выключить нагреватель мощностью 700 Вт и дождаться установления стационарного режима, о чем свидетельствует регулярное включение и выключение реле нагревателя мощностью1300Вт. Сделать запись показаний термометра и манометров обоих пьезометров.
4.Сделав запись давления и температуры в последнем равновесном состоянии, отключить нагреватели термостата и выключить двигатель.
19
Обработка результатов измерений
1. По |
экспериментальным данным построить зависимость |
p = p(T ) |
для двух изохор. |
2. Для одного из стационарных режимов каждой из изохор определить по таблицам p- ρ-T удельный объем и массу углекислого
газа.
3. При полученном удельном объеме нанести на график p = p(T ) изохоры, а) предполагая углекислый газ идеальным;
б) пользуясь табличными p- ρ-T- данными.
4.Объяснить расхождение экспериментальных и расчетных данных.
5.Используя две экспериментальные изохоры углекислого газа, вычислить термические коэффициенты по формулам
ρt |
= − |
1 |
|
|
∂υ |
|
|
|
– коэффициент изотермической |
||||||||
|
|
|
|
|
|
|
|
|
|
|
сжимаемости; |
||||||
υ |
|
|
|
|
|
||||||||||||
|
|
|
|
|
∂p T |
|
|
|
|
||||||||
αp = |
1 |
|
∂υ |
|
|
– коэффициент объемного |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
расширения; |
||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
υ |
∂T p |
|
|
|
||||||||||
γp |
= |
1 |
|
|
|
∂p |
= − |
1 αp |
– температурный |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
коэффициент давления. |
|||||
|
p |
|
∂ |
p |
|
β |
t |
||||||||||
|
|
|
|
|
|
T υ |
|
|
|
|
|||||||
(4)
(5)
(6)
Контрольные вопросы
1.Уравнение Ван-дер-Ваальса.
2.Графическое изображение в p, υ-диаграмме изотерм ван-дер-
ваальсовского газа.
3.Опыты Эндрюса; p, υ-, T,s-диаграммы.
4.Уравнение состояния Майера-Боголюбова, Вукаловича, Новикова.
5.Вириальные ряды.
20
