
Ковалентная полярная связь.
При
взаимодействии атомов, значение
электроотрицательностей которых
отличаются, но не резко, происходит
смещение общей электронной пары к более
электроотрицательному атому. Это
наиболее распространенный тип химической
связи, которой встречается как в
неорганических, так и органических
соединениях. К ковалентным связям в
полной мере относятся и те связи, которые
образованы по донорно-акцепторному
механизму.
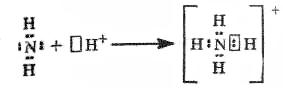 образование
иона аммония по донорно-акцепторному
механизму.
образование
иона аммония по донорно-акцепторному
механизму.
9 Метод валентных связей.
Метод валентных связей впервые был использован в 1927 г. Немецким учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет атома водорода. В методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Гейтлер и Лондон показали, что при сближении двух атомов водорода с антипаралельными спинами происходит уменьшение энергии системы, что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. При сближении атомов с параллельными спинами энергия системы возрастает и молекула в этом случае не образуется. Метод ВС базируется на следующих основных положениях: 1) химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар. 2) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. В образовании общих электронных пар могут участвовать только не спаренные электроны атомов. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад дают кулоновские силы взаимодействия частиц. 3) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипаралельными спинами. 4) характеристики химической связи определяются типом перекрывания АО
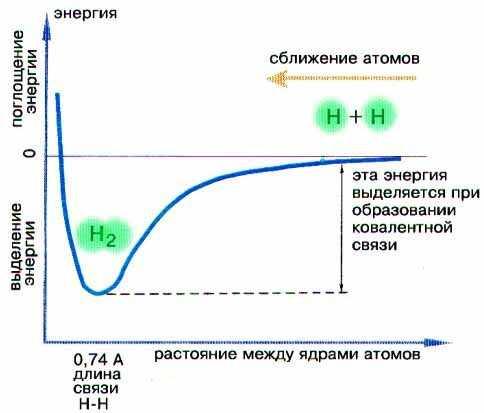
Кривая зависимости энергии связи между молекулами от расстояния
10 Валентность – способность атома к образованию химических связей. Мера валентности - число химических связей. Валентные возможности атома определяются числом неспаренных(валентных) электронов на внешнем слое и числом связей, которые могут быть образованы по донорно-акцепторному механизму.Степень окисления - условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. Это означает, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд -1, две электронных пары - заряд -2. Связь между одинаковыми атомами не дает вклада в степень окисления. Таким образом, связь между атомами С-С соответствует нулевой степени их окисления. В связи C-H углероду как более электроотрицательному атому соответствует заряд -1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1. Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома.Так, в молекуле CH3Cl три связи C-H дают суммарный заряд на атоме C, равный -3, а связь C-Cl - заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна:
- 3+1=-2.
В возбужденном состоянии валентность атомов увеличивается. Это связано с явлением распаривания и промотирования(перехода на свободную орбиталь) электронов внешнего слоя.
11.
Химическая связь - межатомное взаимодействие, обусловленное перекрыванием внешних электронных оболочек атомов сопровождающееся понижением общей энергии образовавшейся системы. Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь), либо при доминировании одним атомом электронной пары, а другим атомом вакантной электронной орбитали (донорно-акцепторная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов. Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорван. Основные типы химической связи- ковалентная , ионная, водородная, металлическая.
Насыщаемость связи обеспечивает постоянный состав молекул и определяет понятие валентность. Если в атоме имеется п неспаренных электронов, то этот атом может образовать п химических связей с другими атомами, имеющими по одному неспаренному электрону. Поэтому валентность элемента равна числу неспаренных электронов в атоме или числу образующихся ковалентных связей. Положение о насыщаемости выводится из принципа Паули и означает, что каждый электрон может участвовать в образовании только одной ковалентной связи. Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда).
12 Водородная связь. Данный вид связи лишь условно можно назвать химическими и правильней его относить к межмолекулярным и внутримолекулярным взаимодействиям. Водородная связь возникает между связанным атомом водорода одной молекулы и электроотрицательным атомом другой молекулы. Водородная связь имеет частично электростатическую, а частично донорно-акцепторную природу. Наглядным примером реализации такой связи может служить объединение нескольких молекул воды в кластеры. В молекуле воды атом кислорода смещает на себя электронную плотность приобретая частичный отрицательный заряд, а водород соответственно - частично положительный и может взаимодействовать с неподеленной электронной парой кислорода соседней молекулы. Водородная связь может возникать не только между разными молекулами, но и внутри самой молекулы.. Ван-дер-ваальсово взаимодействие возникает за счет возникновения наведенных дипольных моментов. Такой вид взаимодействия может возникать как между разными молекулами, так и внутри одной молекулы между соседними атомами за счет возникновения дипольного момента у атомов при движении электронов. Ван-дер-ваальсово взаимодействие может быть притягивающим и отталкивающим. Межмолекулярное взаимодействие носит характер притяжения, а внутримолекулярное - отталкивания. Внутримолекулярное ван-дер-ваальсово взаимодействие оказывает существенный вклад в геометрию молекулы. Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения, теплот парообразования и плавления. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются и химические свойства. Так как многие соединения содержат ковалентные полярные связи Н–О и Н–N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах.. Вследствие невысоких значений энергии водородные связи относительно легко разрушаются и вновь возникают. Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N
