
- •Удк 541.1(07)
- •1 Робота 1
- •1.3 Обчислення результатів:
- •3.3 Обчислення результатів:
- •4.3 На окремому аркуші міліметрового паперу побудувати криві охолодження для всіх дослідів та діаграму плавкості системи Sn-Pb.
- •1 Тиск ртутного стовпчика обчислити за рівнянням:
- •7 Робота 7
- •8 Робота 8
- •9.3 Обробка результатів:
- •10.3 Обчислення результатів:
- •Робота12 визначення ступеню та константи дисоціації оцтової кислоти
- •12.3 Обчислення результатів:
- •14 Робота 14 визначення електрорушійної сили гальванічного елементу
- •14.2 Проведення досліду.
- •14.3 Обчислення результатів:
- •15.4 Висновки.
- •16.3 Обчислення результатів:
- •17.3 Обчислення результатів:
- •18.3 Обчислення результатів:
- •20.3 Протокол аналізу.
- •Зошит до лабораторних робіт з фізичної хімії та контролю металургійного виробництва
- •63/2000 Підп.До друку Формат 60х90/16
3.3 Обчислення результатів:
-теплоємність міді при температурі t1=
С1
=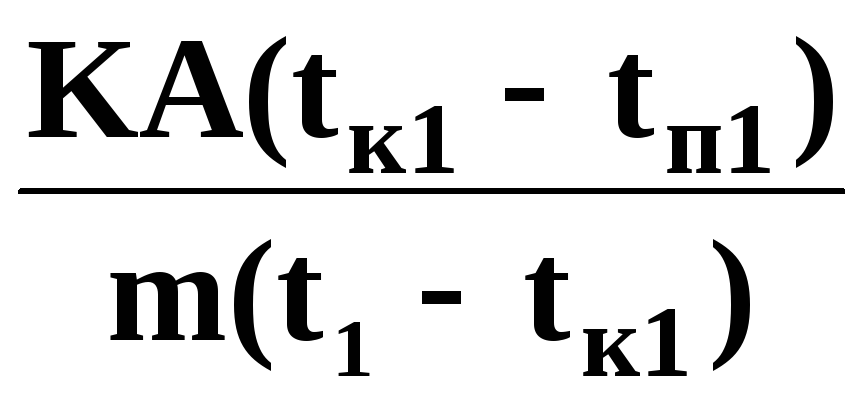 =
=
-теплоємність міді при температурі t2 =
С2=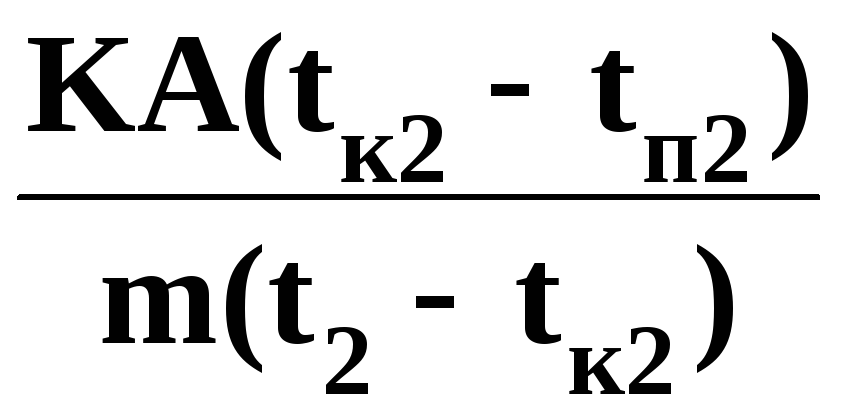 =
=
-стала а0
а0
=
![]() =
=
-стала а1
а1=
![]() =
=
-збільшення ентропії при нагріванні мідного зразка від 298 К до температури Т1
![]()
![]()
![]() =
=
3.4 Висновки.
4 РОБОТА 4
ТЕРМІЧНИЙ АНАЛІЗ СПЛАВІВ
4.1 Мета роботи :
1 Ознайомлення з основними поняттями правила фаз.
2 Ознайомлення з методом побудови діаграми плавкості системи.
3 Побудування кривих охолодження олова, свинця та їх сумішей з різним складом.
4 Побудування діаграми стану (плавкості) системи олово-свинець.
4.2 Проведення досліду.
Таблиця 4.1—Температура початку кристалізації розплаву та температура затвердіння евтектики
|
№ |
Склад розплаву,% |
Температура початку кристалізації розплаву, оС |
Затвердіння евтектики | ||
|
Sn |
Pb |
Температура ,оС |
Тривалість температурної зупинки, хв | ||
|
1 |
100 |
0 |
232 |
-- |
|
|
2 |
80 |
20 |
208 |
183 |
|
|
3 |
62 |
38 |
183 |
183 |
|
|
4 |
50 |
50 |
211 |
183 |
|
|
5 |
25 |
25 |
270 |
183 |
|
|
6 |
0 |
100 |
327 |
-- |
|
Таблиця 4.2 — Зміна температури при охолодженні олова, свинцю та їх сумішей
|
Час від початку охолодження розплаву, хв |
Температура, оС | |||||
|
Номер зразка | ||||||
|
1 |
2 |
3 |
4 |
5 |
6 | |
|
|
|
|
|
|
|
|
4.3 На окремому аркуші міліметрового паперу побудувати криві охолодження для всіх дослідів та діаграму плавкості системи Sn-Pb.
4.4 Висновки.
5 РОБОТА 5
ВИЗНАЧЕННЯ ТЕПЛОТИ ВИПАРОВУВАННЯ РІДИНИ
5.1 Мета роботи:
1 Ознайомлення з рівнянням Клаузіуса-Клапейрона.
2 Ознайомлення з методом визначення тиску насиченої пари.
3 Визначення тиску насиченої пари ефіру при різних температурах.
4 Визначення теплоти випаровування ефіру.
Проведення досліду.
Таблиця 5.1 — Тиск насиченої пари ефіру при різних температурах
Атмосферний тиск Ра= Па
Температура повітря t= оС
|
Температура досліду |
Рівень ртуті,мм |
Тиск ртутного стовпчика Р0 |
Тиск пари ефіру Р=Рат-Р0, Па |
lgP | |||
|
оС |
К |
верхній h1 |
нижній h2 |
мм |
Па | ||
|
-10 |
263 |
|
|
|
|
|
|
|
0 |
273 |
|
|
|
|
|
|
|
+10 |
283 |
|
|
|
|
|
|
Примітки:
1 Тиск ртутного стовпчика обчислити за рівнянням:
Р0= h1 – h2.
2 Тиск насиченої пари ефіру обчислити за рівнянням:
Р=Ратм – Р0.
Обчислення результатів:
-експериментальне значення мольної теплоти випаровування ефіру
Lвип=![]()
![]()
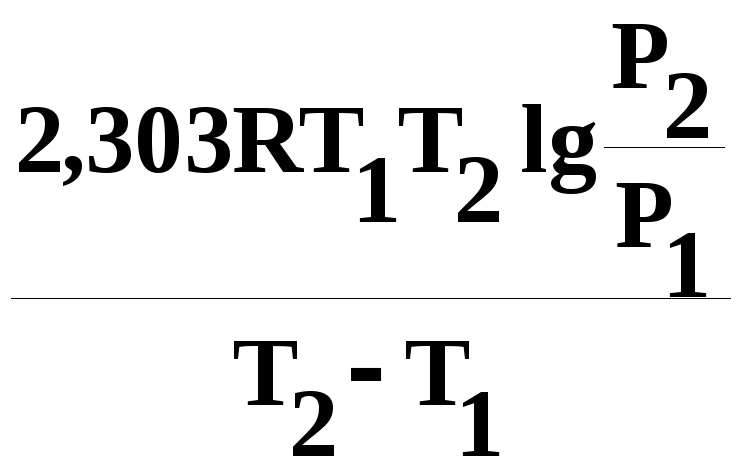 =
=
Висновки.
6 РОБОТА 6
ВИЗНАЧЕННЯ КОНСТАНТИ РІВНОВАГИ РЕАКЦІЇ
6.1 Мета роботи:
1 Ознайомлення з параметрами зворотної гомогенної реакції.
2 Ознайомлення з методом дослідження рівноваги гомогенної реакції.
3 Визначення константи рівноваги гомогенної реакції
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl .
6.2Проведення досліду.
Таблиця 6.1. – Кількість мілілітрів 0,02 М розчину тіосульфату натрію, що пішли на титрування проб
Температура досліду t= oC
|
№ проби |
Час відбору проби ,хв |
Об'ем розчину тіосульфату натрію, мл |
|
1 |
5 |
|
|
2 |
10 |
|
|
3 |
15 |
|
|
4 |
20 |
|
|
5 |
25 |
|
Обчислення результатів:
-рівноважна концентрація йоду в розчині
СJ2
=
CNa2S2O3 =
=![]()
-рівноважна концентрація Fe2+
CFe2+ = 2CJ2 =
-початкова концентрація FeCl3
CFeCl3
=C0
![]() =
=
-рівноважна концентрація іонів Fe3+:
CFe3+ =CFeCl3 – 2CJ2 =
-початкова концентрація KJ
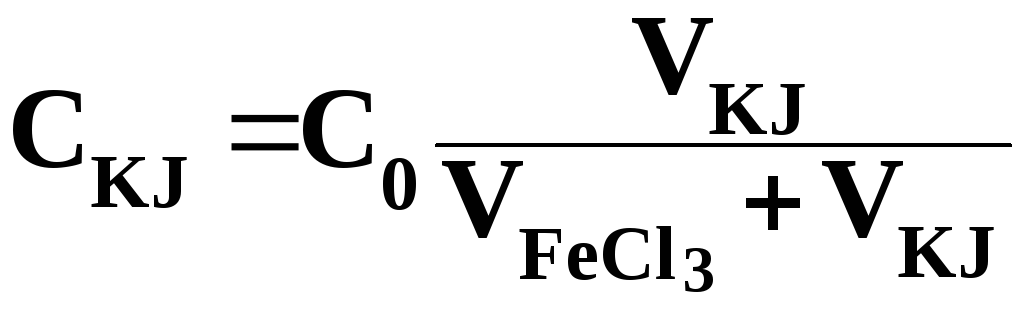 =
=
-рівноважна концентрація іонів J–
CJ–=CKJ – 2CJ2 =
-константа рівноваги реакції

-енергія Гельмгольца реакції
ΔFT= - RTlgKC = - 2,303RTlgKC=
Висновки
