- •18. Валентность. Метод валентных связей.
- •30. Энтропия. Второй закон термодинамики. Энергия Гиббса, определение направления протекания процесса и состояния равновесия.
- •46. Ионное произведение воды, водородный показатель, кислотно-основные индикаторы.
- •50. Гальванический элемент Даниэля-Якоби. Анод, катод, токообразующая реакция, схема элемента.
- •53. Электролиз.
- •54. Законы Фарадея. Выходы по току.
1. Химия – это наука, изучающая вещества и процессы их превращения, сопровождающиеся изменением состава и строения вещества. Химия – наука о веществах, их строении, свойствах и превращениях. Химия изучает явления, которые происходят на микроскопическом уровне, т.е. на атомно-молекулярном. Химия состоит из таких разделов, как неорганическая химия, органическая химия, физическая химия.
Значение химии:
-
создание материалов с заданными свойствами;
-
обработка новых материалов;
-
разработка новых технологий;
-
защита металлов и металлических конструкций от коррозии.
2.Основные понятия в химии:
Химический элемент-это совокупность атомов с одинаковыми зарядами атомных ядер и одинаковым числом электронов в атомной оболочке.
Атом – это сложная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. это наименьшая частица элемента в химических соединениях; химически неделимая частица, из которых состоят молекулы. Атом состоит из ядер и электронов. Ядра из протонов и нейтронов. Протон – частица с зарядом +1 (их число обозначается Z). Нейтрон – частица, имеющая нулевой заряд (их число обозначается N). Общее название этих частиц – нуклоны. Общее число нуклонов в ядре называют массовым числом A: A=Z+N.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами (определение 1860 года). Современное определение: молекула – это наименьшая электронейтральная замкнутая совокупность атомов, образующих определенную структуру с помощью химических связей. Молекулы бывают одноатомными (Н), двухатомные (О2), многоатомные (H2SO4).
Вещество – это любая совокупность атомов и молекул. Вещества бывают простые и сложные. Простые вещества образованы атомами одного элемента. Сложные вещества, или химические соединения состоят из атомов разных элементов, связанных между собой постоянными соотношениями.
Аллотропия- существование одного и того же хим. элемента в виде двух или нескольких простых веществ различных по строению и свойствам.
Моль – это количество вещества системы, которое содержит столько же структурных элементов, сколько атомов содержится в 0,012кг изотопа углерода С12.
молярная масса- масса одного моля в-ва.
число Авагадро- физическая константа, численно равная количеству специфицированных структурных единиц(атомов, молекул) в 1 моле в-ва. N=6,02*10 в23
3. Основные законы химии:
1.закон сохранения массы в-ва: масса реагирующих в-в, равна массе продуктов реакции.
-
закон сохранения массы и энергии (Ломоносов): в изолированной системе сумма массы и энергии постоянна. Е=mc2.
-
закон постоянства состава вещества(Ж.Пруст): независимо от нахождения в природе или способа получения любое химическое соединение имеет постоянный качественный и количественный состав.
-
закон эквивалента (Рихтер):в молекулярных соединениях, массы составляющих, их элементов относятся между собой как их эквиваленты. все вещества реагирующие строго в эквивалентном соотношении. Эквивалент – это реальные частицы вещества, которые могут присоединять, замещать, освобождать или быть каким либо другим.
-
закон кратных отношений (Дж.Дальтон, 1803): если два элемента могут образовывать между собой несколько соединений, то массовые доли любого из элементов в этих соединениях относятся друг к другу как небольшие целые числа .
закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствия:
-одинаковое кол-во молекул любых газов при одинаковых условиях занимают одинаковый объем.
-относительная плотность одного газа по другому равна отношению их молярных масс.
4.
5. пространство вокруг ядра где наиболее вероятно нахождение данного электрона, наз. орбиталью этого электрона.
ур-е Планка:
ур-е Де-Бройля:
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств.
ур-е Шредингера:ур-е описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией,в гамильтоновых квантовых системах(ур-е движение квантовой частицы)1926г.Ур-е Шр. предназначено для частиц без спина, движущихся со скоростями много меньшими скорости света.
ур-е Шр. для атома водорода:
Квантовые числа-энергетические параметры, определяющие состояние электрона и тип атомной орбитали,на которой он находиться.
7.Атомные спектры(оптич.)-получающиеся при испускании или поглощении света(электромагнитных волн) свободными или слабосвязанными атомами; такими спектрами обладают одноатомные газы или пары.
Главное квантовое число n. принимает значения n=1,2,3..определяет полную энергию электрона в любом квантовом состоянии.
Орбитальное квантовое число i.в квантовых состояниях с заданным значением главного квантового числа n орбитальное число может иметь следующие значения:i=1.2.3..(n-1)
орбитали:
8.Магнитное квантовое число отражает влияние внешнего магнитного поля на состояние электрона и определяет ориентацию орбиталей в пространстве. Это число показывает максимально возможное число орбиталей для каждой оболочки.
Спиновое квантовое число показывает направление собственного момента вращения,который наз.спином. Вращаться электрон может только в двух состояниях:по часовой «спин вверх» (s=1/2) и против «спин вниз» (s=-1/2)
9.правило Клечковского: орбитальная энергия последовательно повышается по мере увеличения суммы n+i, причем при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением гл.квантового числа n.
правило Гунда: определяет порядок заполнения орбиталей определеннго подслоя:суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Принцип Паули: в атоме не может быть двух электронов,обладающих одинаковыми свойствами(у которых все 4 квантовых числа были бы одинаковы)
10. В химии валентными электронами называют электроны, находящиеся на внешней, или валентной, оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических реакциях при прочих равных условиях. Полностью заполненные внешние электронные оболочки имеют инертные газы, которые проявляют минимальную химическую активность. Периодичность заполнения электронами внешней электронной оболочки определяет периодическое изменение химических свойств элементов в таблице Менделеева.
В зависимости от того какой подуровень последним заполняется электронами,все эл-ты делят на 4 семейства:
У s-элементов последним заполняется s подуровень,внешн.уровня.к ним относятся первые 2 эл-та каждого периода.(Са)
У р-элементов последним заполняется р подуровень,внеш. уровня.к ним относятся последние 6 эл-тов каждого периода.(Ga)
У d-элементов последним заполняется d подуровень предвнешнего уровня,они расположены между s и p элементами начиная с 4 периода.(У)
У f-элементов заполняется f подуровень третьего снаружи уровня.
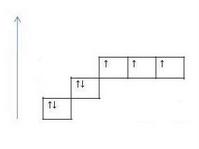
11. Валентность-это кол-во ковалентных связей,которое образует атом с ковалентной связью.
|
|
|
Валентность азота равнаIII, т.к. азот образует три связи |
|
|
|
Валентность азота равнаIV, т.к. азот образует четыре связи |
Валентность атома хим.эл-та не может быть выше полного числа орбиталей на внешнем уровне этого эл-та.
Например,
|
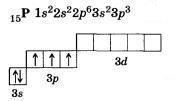
Азот |
7 N 1s22s22p3
|
У атома азота на внешнем втором уровне 1s и 3pорбитали, всего 4 орбитали, следовательно, максимально возможная валентность равнаIV |
|
Фосфор |
|
У атома фосфора в основном (стационарном) состояниивалентность как и у азота равна IV |
|
|
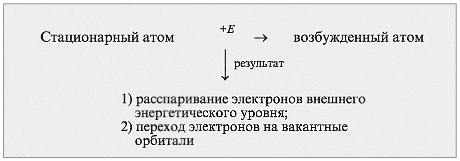
У атома фосфора, в отличие от азота есть свободные d– орбитали, поэтому для фосфора характерновозбуждённое состояние, когда 3s2 электроны распариваются и валентность принимает значение V |
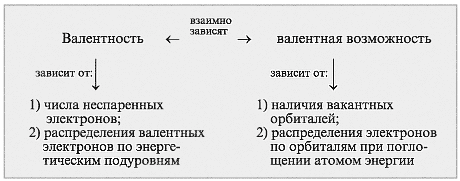
Валентные возможности атомов определяются числом неспаренных электронов,а также числом неподеленных электронных пар способных переходить на свободные орбитали атома другого эл-та.
например:Образование третьей связи при образовании иона гидроксония,неподеленная пара электронов атома кислорода(донор) переходит на свободную орбиталь иона водорода(акцептор)
![]()
![]()
Рассмотрим электронографические формулы эл-тов и установим причину разной валентности

Валентность С-2 и 4,а Н-1, Не-0, Ве-2,В-3,Р-5.
 Расход
энергии на перевод атома в возбужденное
состояние компенсируется энергией,выделяющийся
при образовании хим.связи.
Расход
энергии на перевод атома в возбужденное
состояние компенсируется энергией,выделяющийся
при образовании хим.связи.
 Валентные
возможности атомов хим.эл-тов опр:
Валентные
возможности атомов хим.эл-тов опр:
-числом неспаренных электронов (одноэлектронных орбиталей)
-наличием свободных орбиталей
-наличием неподеленных пар электронов
Способность атома присоединять или замещать опр. число других атомов с образованием хим.связей наз.валентностью.
Возбуждение атома это преход одного из спаренных электронов с однго подуровня на свободную орбиталь другого подуровня в пределах в пределах одного и того же уровня.
Периодический закон Менделеева:св-ва эл-тов,а потому и св-ва образуемых ими прост. и сложн.тел стоят в периодической зависимости от их атомного веса.
Закон Мозли:корень квадратный из волнового числа опр.линии характеристического рентгеновского спектра есть линейная функция заряда ядра атома порядкового № эл-та.
Современная формулировка период.закона:Св-ва эл-тов,а также формы и св-ва их соединений наход.в период.зависимости от заряда ядер и их атомов поряд№ их эл-та.
Структура период.системы:по № периода в атоме опр. число энергетич.уровней и номер вн.уровня.в таблице 8 групп,в кажд.гр.различ.гл.подгруппу это d и f элементы.элементы одной подгруппы имеют аналог.стр-ру вн.уровня(s и p эл.) и предвнеш.(d эл.) наз.электр.аналогами.они имеют сходн.хим.св-ва.по №группы можно опр.макс.валентность эл-та и высш.степ.окисл.соединения.она проявл. в оксидах макс.число электронов=8,на внеш.уровне.
13.Сродство к электрону(Eср) – энергия, которая выделяется при присоединении электрона к атому: X + e → X– . Eср выражается в кДж/моль или в эВ. Наибольшее сродство к электрону имеют галогены, кислород, сера, наименьшие (иногда отрицательное) – у металлов. Сродством к электрону называется энергетический эффект F процесса присоединения электрона к атому.
Э0 + e = Э F.
В периодах сродство к электрону и окислительные свойства элементов возрастают, в группах, как правило, уменьшаются.
11. Энергия ионизации.
Энергией ионизации называется количество энергии I, необходимое для отрыва электрона от атома или иона:
Э0 + I = Э+ +e.
По периоду энергия ионизации немонотонно возрастает. Резкие максимумы соответствуют атомам благородных газов, которые обладают наиболее устойчивой электронной конфигурацией s2p6. В пределах одной группы с увеличением порядкового номера энергия ионизации обычно убывает, что связано с увеличением расстояния внешнего электронного уровня от ядра. Энергия ионизации является мерой восстановительной способности атома.
12. Электроотрицательность (ЭО). Способность атомов в соединениях притягивать к себе электроны. Возрастает по периоду, убывает по группам у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум у Al), возрастает с увеличением номера периода у элементов VII – VIII побочных подгрупп. Наименьшие значения s-элементы I подгруппы, наибольшие значения – p-элементы VI и VII групп.
Понятие электроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно Малликену, электроотрицательность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону: ЭО = 1/2 (I + F). В периодах наблюдается общая тенденция роста величины электроотрицательности, а в группах - ее падения.
13. Радиус атома орбитальный - теоретически рассчитанное положение главного максимума плотности внешних электронных облаков. Практически приходится пользоваться эффективным. Эффективный радиус - 1/2 расстояния между ядрами атомов химически связанных элементов. В периодах атомные радиусы по мере увеличения заряда ядра, в общем, уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, притяжение им электронов. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных уровней.
Периодическая система элементов – графическое изображение Периодического закона.
Номер элемента обозначает количество протонов в ядре и количество электронов в поле ядра.
Элементы в системе Менделеева расположены в порядке возрастания их атомного номера и в соответствии с распределением электронов вокруг ядра. В таблице 7 периодов, 10 рядов, 8 групп, пока известно 109 элементов. В горизонтальных рядах – периодах – элементы располагаются, начиная от типичных металлов, через элементы, обладающие свойством амфотерности (двойственности), к неметаллам. Заканчиваются все периоды инертными газами. Первый период содержит 2 элемента, второй и третий – по 8, четвертый и пятый – по 18, шестой – 32 и седьмой (незавершенный) – 26 элементов. В малых периодах с увеличением порядкового номера усиливаются неметаллические свойства элементов.
По вертикали – элементы располагаются по группам (группой называют совокупность элементов с одинаковым значением максимальной валентности, равным номеру группы). Их всего 8. Сверху вниз возрастают металлические свойства элементов. Группы делятся на главные и побочные, которые отличаются количеством электронов на внешнем энергетическом уровне. Все элементы побочных подгрупп (переходные элементы) – металлы.
Химические элементы, расположенные после урана (порядковый номер 92), называют трансурановыми. Это элементы 93 – 109. они получены искусственно. Их ядра крайне нестабильны. Элементам 106 – 109 названия пока не присвоены.
9. s-, p-, d-, f-элементы, их расположение в периодической системе.
Первый период состоит из двух элементов: водорода и гелия. Атомом гелия заканчивается формирование K-оболочки атома, обозначим ее [Не]. Электрон, который последним заполняет орбитали атома, называется формирующим, и элемент относится к группе, называемой по формирующему электрону. В данном случае оба элемента имеют формирующие s-электроны и соответственно называются s-элементами У элементов второго периода формируется L-оболочка, заполняются s- и p-подоболочки. Формирующими электронами у первых двух элементов являются s-электроны, поэтому Li и Be относятся к s-элементам. Остальные шесть элементов периода входят в число р-элементов, так как формирование их орбиталей заканчивается p-электроном. У элемента Ne полностью заполнена 2р-подоболочка, обозначим его электронную конфигурацию как [Ne].Третий период начинается с натрия, электронная конфигурация которого 1s22s22p63s1 и заканчивается аргоном с электронной конфигурацией 1s22s22p63s23p6[Аr]. Хотя в третьем уровне (оболочка М) имеется подоболочка 3d которая остается незаполненной, в четвертом периоде начинает формироваться следующая оболочка N (n=4) и период начинается с s-элемента калия, [Аr]4s1. Это обусловлено тем, что энергия подуровня 4s несколько ниже, чем энергия подуровня 3d (см. рис. 1.5). В соответствие с правилом Клечковского n+1 у 4s(4) ниже, чем n+1 у 3d(5). После заполнения 4s-подоболочки заполняется 3d-подоболочка. Элементы от Sc [Ar] 3d1 4s2 до Zn [Ar] 3d |04s2, имеющие формирующие d-электроны, относятся к d-элементам. Как видно из табл. 1.3, у хрома на 4s-подоболочке остается один электрон, а на 3d-подоболочке вместо четырех оказывается пять d-электронов. Такое явление получило название «провала» электрона с s- на d-подоболочку. Это обусловлено более низкой энергией конфигурации 3d54s] по сравнению с конфигурацией 3d44s2. «Провал» электронов наблюдается и у других атомов, например у атомов Си, Nb, Mo, Pt, Pd Четвертый период завершается формированием подоболочки 4р у криптона [Аг] 3d104s24p6 или [Кг]. Всего в четвертом периоде 18 элементов. Пятый период аналогичен четвертому периоду. Он начинается с s-элемента рубидия [Кг] 5s1 и заканчивается p-элементом ксеноном [Кr] 4d105s25p6 или [Хе] и включает в себя десять 4d-элементов от иттрия до кадмия. Всего в пятом периоде 18 элементов. В шестом периоде, как и в пятом, после заполнения s-подоболочки начинается формирование d-подоболочки предвнешнего уровня у лантана. Однако, у следующего элемента энергетически выгоднее формирование 4f-подоболочки по сравнению с 5d-подоболочкой. Поэтому после лантана следует 14 лантаноидов с формирующими f-электронами, т.е.f-элементов от церия Се [Хе] 4f25d°6s2 до лютеция Lu [Хе] 4f145dl6s2. Затем продолжается заполнение оставшихся орбиталей в 5d-подоболочке и 6p-подоболочке. Период завершает радон [Хе] 4f145d°6s26p6 или [Rn]. Таким образом период имеет 32 элемента: два s-элемента, шесть p-элементов, десять d-элементов и четырнадцать элементов. Седьмой период начинается и продолжается аналогично шестому периоду, однако формирование его не завершено. Он также имеет вставную декаду из d-элементов и четырнадцать 5/элементов (актиноидов)
14. Химическая связь - электростатическое взаимодействие двух атомов, осуществляемое путем обмена электронами. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару – поделенная пара. При сближении атомов валентные электроны одного атома начинают притягиваться к ядрам другого атома и, наоборот, валентные электроны второго атома притягиваются к ядрам первого. Главный результат образования химической связи – уменьшение общей энергии системы ядер и электронов, а достигается этот результат путем совместного использования электронов разными ядрами. Электронная плотность между атомами, образующими химическую связь, увеличивается. При образовании химической связи атом стремится завершить внешний уровень и приобрести электронную конфигурацию инертного газа, отдавая или принимая электроны. В зависимости от того, как происходит обмен электронами, различают следующие виды химической связи: ковалентную (полярную и неполярную), ионную, водородную, металлическую (связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов).
основные черты химической связи:
-
снижение общей энергии системы по сравнению с суммарной энергией изолированных частиц, из которых это система состоит.
-
перераспределение электронной плотности в области химической связи.
15. Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Не обладает направленностью и насыщенностью.
16. Ковалентная связь - связь, осуществляемая за счет образования общих электронных пар, принадлежащих обоим атомам. Общая пара электронов может быть получена двумя способами: 1) каждый из атомов отдает в общее пользование по одному электрону (обменный механизм); 2) один атом отдает в общее пользование два электрона, а другой ни одного (донорно-акцепторный механизм).
Направленность – обуславливает пространственную структуру молекул, т.е. их геометрию (форму).
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Вследствие насыщаемости связей молекулы имеют определенный состав: H2, CH4, H2S, HCl.
Полярность связи характеризует степень смещения общей электронной пары к одному из атомов. Ковалентную связь, образованную одинаковыми атомами называют неполярной, а связь образованную разными атомами – полярной.
Валентный угол (угол между связями) – угол между линиями, соединяющими химически связанные атомы. Валентные углы в разных молекулах могут изменяться от 600 до 1800.
Кратность (порядок) связи – число электронных пар, участвующих в образовании связи. Для обычных ковалентных связей это число может быть равно 1,2 или 3.
Обменный механизм образования ковалентной связи. При сближении атомов, содержащих Неспаренные электроны, электронные оболочки атомов перекрываются между собой. При этом возникает общая пара электронов, одновременно принадлежащая обоим атомам. Каждый атом предоставляет в эту пару по одному неспаренному электрону. Пример: H. +.H → H:H или Н-Н. общую пару электронов иногда обозначают черточкой, которая и символизирует химическую связь. В образующейся молекуле Н2 каждому атому водорода принадлежат два электрона, т.е. эти атомы имеют такую же электронную конфигурацию, как и атом инертного газа гелия.
18. Валентность. Метод валентных связей.
Валентность атома – число химических связей, образованных данным атомом в соединении. Под числом химических связей подразумевают число общих пар электронов. В структурной формуле соединения, где химические связи изображены черточками, число черточек, отходящих от данного атома, равно его валентности. Пример. Атом кислорода в оксидах углерода СО и СО2 имеет валентность III и II, соответственно. Атом углерода в этих молекулах имеет валентность III и IV:
О≡С, О≡С≡О.
Понятие «валентность» применимо только к соединениям с ковалентными связями или к молекулам в газовой фазе. Валентность – это способность атомов присоединять или замещать определенное число атомов другого элемента.
Метод валентных связей.
А) химическая связь между двумя атомами возникает как результат перекрытия АО с образованием электронных пар.
Б) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.
В) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с разными спинами.
Г) характеристики химической связи (энергия, длина, полярность) определяются типом перекрывающихся АО.
Метод валентных связей. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
14-15 Донорно-акцепторный механизм образования ковалентной связи. Донор, акцептор. При образовании донорно-акцепторной ковалентной связи один атом (донор) предоставляет в общее пользование электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь (орбиталь – область пространства, где наиболее вероятно нахождение электрона). Пример. Образование иона аммония (точками обозначена неподеленная пара электронов атома азота, пустым квадратиком – свободная 1s-орбиталь иона водорода):
В ионе аммония каждый из четырех атомов водорода связан с атомом общей электронной парой; три пары из четырех образованы по обменному механизму, одна – по донорно-акцепторному. Все связи H-N, образованные по двум различным механизмам, равноценны.
В качестве доноров обычно выступают атомы с большим количеством электронов, имеющие неподеленные пары электронов; например, азот, кислород, фтор.
Сигма-связь, пи-связь, дельта-связь, кратные связи.
δ-связь – ковалентная связь, образованная при перекрывании атомных орбиталей по линии, соединяющей ядра атомов.
π-связь – ковалентная связь, образованная при перекрывании атомных орбиталей вне линии, соединяющей ядра атомов.
дельта-связь – это
Пространственная конфигурация молекул. Линейная, угловая, плоская, тригональная, пирамидальная, тетраэдрическая.
Пространственная форма молекул – относительное расположение ядер атомов в пространстве.
Линейная: число электронных пар химических связей – 2; угол между связями – 1800; пример молекулы – ВеН2.;
угловая: число электронных пар химических связей – пример молекулы – Н2О;
плоская:
тригональная:
пирамидальная:
тетраэдрическая: число электронных пар химических связей – 4; угол между связями – 109,50; пример молекулы – СН4.
17 Гибридизация атомных орбиталей. Типы гибридизации.
Гибридизация атомных орбиталей – изменение формы некоторых атомных орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа.
Наиболее распространены следующие типы гибридизации:
-
sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые гибридные орбитали, оси которых расположены под углом 109,50 друг к другу. sp3-гибридизация имеет место в молекулах NH3, Н2О и во всех предельных углеводородах.
-
sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые гибридные орбитали, оси которых расположены под углом 1200 друг к другу. sp2-гибридизация имеет место в молекулах BF3, AlCl3, а также во всех этиленовых и ароматических углеводородах.
-
sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые гибридные орбитали, оси которых расположены под углом 1800 друг к другу. sp-гибридизация имеет место в молекулах BeH2, BeF2, CO2, а также во всех ацетиленовых углеводородах.
18. Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называетсянеполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Если
атомы различны, то степень владения
обобществленной парой электронов
определяется различием
в электроотрицательностях атомов.
Атом с большей электроотрицательностью
сильнее притягивает к себе пару электронов
связи, и его истинный заряд становится
отрицательным. Атом с
меньшей
электроотрицательностью приобретает,
соответственно, такой же по величине
положительный заряд. Если соединение
образуется между двумя различными неметаллами,
то такое соединение называется ковалентной
полярной связью.Дипольный
момент электрический,
векторная величина, характеризующая
асимметрию распределения положительных
и отрицательных зарядов в электрически
нейтральной системе. Два одинаковых по
величине заряда +qи —q образуют
электрический диполь с дипольный момент
m = q
l, где l -
расстояние между зарядами. Для системы
изn зарядов qi радиусы-векторы
которых ri, 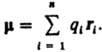 В молекулах и
молекулярных системах центры положительных
зарядов qА совпадают
с положениями атомных
ядер (радиусы-векторы rA),
а электронное распределение описывается
плотностью вероятности r(r).
В
этом случае дипольный момент
В молекулах и
молекулярных системах центры положительных
зарядов qА совпадают
с положениями атомных
ядер (радиусы-векторы rA),
а электронное распределение описывается
плотностью вероятности r(r).
В
этом случае дипольный момент  Вектор
дипольный момент направлен от центра
тяжести отрицательных зарядов к центру
тяжести положительных. В хим. литературе
дипольный момент молекулы иногда
приписывают противоположное направление.
Часто вводят представление о дипольный
момент отдельных хим. связей, векторная
сумма которых дает дипольный момент
молекулы. При этом дипольный момент
связи определяют двумя положительными
зарядами ядер атомов, образующих связь,
и распределением отрицательного
(электронного) заряда.Дипольный момент
химической связи обусловлен смещением
электронного облака в сторону одного
из атомов. Связь называют полярной, если
соответствующий дипольный момент
существенно отличается от нуля. Возможны
случаи, когда отдельные связи в молекуле
полярны.
а суммарный дипольный момент молекулы
равен нулю; такие молекулы наз. неполярными
(напр., молекулы СО2 и
CCl4).
Если же дипольный момент молекулы
отличен от нуля, молекула наз. полярной.
Напр., молекула Н2О
полярна; суммирование дипольных моментов
двух полярных связей ОН также дает
отличный от нуля дипольный момент,
направленный по биссектрисе валентного
угла НОН.Порядок
величины дипольный момент молекулы
определяется произведением
заряда электрона (1,6.10-19 Кл)
на длину химической связи (порядка
10-10 м),
т. е. составляет 10-29 Кл.м.
В справочной литературе дипольный
момент молекул приводят в дебаях (Д или
D), по имени П. Дебая; 1 Д =
3,33564.10-30 Кл.м.Спектроскопические
методы определения дипольного момента
молекул основаны на эффектах расщепления
и сдвига спектральных линий в электрическом
поле (эффект Штарка). Для линейных молекул
и молекул типа симметричного волчка
известны точные выражения, связывающие
дипольный момент со штарковским
расщеплением линийвращательных
спектров.
Этот метод дает наиб. точные значения
величины дипольный момент (до 10-4 Д),
причем экспериментально определяется
не только величина, но и направление
вектора дипольный момент Важно, что
точность определения дипольный момент
почти не зависит от его абсолютной
величины. Это позволило получить весьма
точные значения очень малых дипольный
момент ряда молекул углеводородов.
которые нельзя надежно определить
другими методами. Так, дипольный
момент пропана равен
0,085 b 0,001
Д, пропилена 0,364
b 0,002 Д, пропина 0,780 b 0,001 Д, толуола 0,375 b
0,01 Д, азулена 0,796 b 0,01 Д. Область применения
метода микроволновой спектроскопии
ограничена, однако, небольшими молекулами,
не содержащими атомов тяжелых
элементов. Направление вектора дипольный
момент молекулы может быть определено
экспериментально и по эффекту Зеемана
второго порядка.Другая
группа методов определения дипольных
моментов основана на измерениях
диэлектрической проницаемости ε
вещества. Этими методами измерены
дипольные моменты молекул более 10 тыс.
веществ. Переход от измеряемого значения
ε газа, чистой жидкости или разбавленного
раствора, то есть макроскопической
характеристики диэлектрика, к величине
дипольного момента основан на теории
поляризации диэлектриков. Считается,
что при наложении электрического поля
на диэлектрик его полная поляризация Р (средний
дипольный момент единицы объема)
складывается из наведенной, или
индуцированной, поляризации Рм и
ориентационной поляризации Рор и
связана с m ур-нием Ланжевена - Дебая:
Вектор
дипольный момент направлен от центра
тяжести отрицательных зарядов к центру
тяжести положительных. В хим. литературе
дипольный момент молекулы иногда
приписывают противоположное направление.
Часто вводят представление о дипольный
момент отдельных хим. связей, векторная
сумма которых дает дипольный момент
молекулы. При этом дипольный момент
связи определяют двумя положительными
зарядами ядер атомов, образующих связь,
и распределением отрицательного
(электронного) заряда.Дипольный момент
химической связи обусловлен смещением
электронного облака в сторону одного
из атомов. Связь называют полярной, если
соответствующий дипольный момент
существенно отличается от нуля. Возможны
случаи, когда отдельные связи в молекуле
полярны.
а суммарный дипольный момент молекулы
равен нулю; такие молекулы наз. неполярными
(напр., молекулы СО2 и
CCl4).
Если же дипольный момент молекулы
отличен от нуля, молекула наз. полярной.
Напр., молекула Н2О
полярна; суммирование дипольных моментов
двух полярных связей ОН также дает
отличный от нуля дипольный момент,
направленный по биссектрисе валентного
угла НОН.Порядок
величины дипольный момент молекулы
определяется произведением
заряда электрона (1,6.10-19 Кл)
на длину химической связи (порядка
10-10 м),
т. е. составляет 10-29 Кл.м.
В справочной литературе дипольный
момент молекул приводят в дебаях (Д или
D), по имени П. Дебая; 1 Д =
3,33564.10-30 Кл.м.Спектроскопические
методы определения дипольного момента
молекул основаны на эффектах расщепления
и сдвига спектральных линий в электрическом
поле (эффект Штарка). Для линейных молекул
и молекул типа симметричного волчка
известны точные выражения, связывающие
дипольный момент со штарковским
расщеплением линийвращательных
спектров.
Этот метод дает наиб. точные значения
величины дипольный момент (до 10-4 Д),
причем экспериментально определяется
не только величина, но и направление
вектора дипольный момент Важно, что
точность определения дипольный момент
почти не зависит от его абсолютной
величины. Это позволило получить весьма
точные значения очень малых дипольный
момент ряда молекул углеводородов.
которые нельзя надежно определить
другими методами. Так, дипольный
момент пропана равен
0,085 b 0,001
Д, пропилена 0,364
b 0,002 Д, пропина 0,780 b 0,001 Д, толуола 0,375 b
0,01 Д, азулена 0,796 b 0,01 Д. Область применения
метода микроволновой спектроскопии
ограничена, однако, небольшими молекулами,
не содержащими атомов тяжелых
элементов. Направление вектора дипольный
момент молекулы может быть определено
экспериментально и по эффекту Зеемана
второго порядка.Другая
группа методов определения дипольных
моментов основана на измерениях
диэлектрической проницаемости ε
вещества. Этими методами измерены
дипольные моменты молекул более 10 тыс.
веществ. Переход от измеряемого значения
ε газа, чистой жидкости или разбавленного
раствора, то есть макроскопической
характеристики диэлектрика, к величине
дипольного момента основан на теории
поляризации диэлектриков. Считается,
что при наложении электрического поля
на диэлектрик его полная поляризация Р (средний
дипольный момент единицы объема)
складывается из наведенной, или
индуцированной, поляризации Рм и
ориентационной поляризации Рор и
связана с m ур-нием Ланжевена - Дебая:
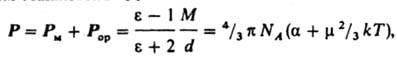 где
М - мол. масса, d - плотность, a - поляризуемость
молекулы, NA -
число Авогадро, k
- постоянная
Больцмана, Т - абсолютная температура.
Измерения диэлектрической проницаемости
проводят в постоянном поле или при
низких частотах, обеспечивающих полную
ориентацию молекул по полю. При наиболее
распространенном варианте метода -
измерениях в разбавленных растворах
неполярных растворителей - предполагается
аддитивность поляризаций растворенного
вещества и растворителя. Поляризуемость
связи выражается в смещении электронов
связи под влиянием внешнего электрического
поля, в том числе и другой реагирующей
частицы. Поляризуемость определяется
подвижностью электронов.
Полярность и поляризуемость ковалентных
связей определяет реакционную способность
молекул по отношению к полярным реагентам.
где
М - мол. масса, d - плотность, a - поляризуемость
молекулы, NA -
число Авогадро, k
- постоянная
Больцмана, Т - абсолютная температура.
Измерения диэлектрической проницаемости
проводят в постоянном поле или при
низких частотах, обеспечивающих полную
ориентацию молекул по полю. При наиболее
распространенном варианте метода -
измерениях в разбавленных растворах
неполярных растворителей - предполагается
аддитивность поляризаций растворенного
вещества и растворителя. Поляризуемость
связи выражается в смещении электронов
связи под влиянием внешнего электрического
поля, в том числе и другой реагирующей
частицы. Поляризуемость определяется
подвижностью электронов.
Полярность и поляризуемость ковалентных
связей определяет реакционную способность
молекул по отношению к полярным реагентам.
21. Комплексные соединения (лат. complexus — сочетание, обхват), или координационные соединения (лат. co — «вместе» иordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+) либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Комплексное соединение – химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия " комплексная частица" нет. Обычно используется следующее определение.
Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы подонорно-акцепторному механизму.
Классифика́ция (классифицирование) — процесс группировки объектов исследования или наблюдения в соответствии с их общими признаками. В результате разработанной классификации создаётся классифицированная система (часто называемая так же, как и процесс — классификацией). Таксономия (от др.-греч. τάξις — расположение, строй, порядок и νόμος — закон) — теория классификации и систематизации сложноорганизованных областей действительности, имеющих обычно иерархическое строение (органический мир, объекты географии, геологии, языкознания, этнографии и т. п.).
Являясь в большей или меньшей степени условной (соответственно субъекту её осуществляющему и его восприятию «общности признаков»), классификация может позволить упростить общение людей, её применяющих (в случае, если это восприятие «общности признаков» само оказалось достаточно общим). Например, можно использовать понятие монотонной функции, не обращаясь каждый раз к определению, выделяющему это подмножество функций из множества функций вообще.
Номенклату́ра (лат. nomenclatura — перечень, роспись имён)
Система (совокупность) названий, терминов, употребляемых в науке, технике и т. п. (см. Номенклатура химическая, Научная классификация биологических видов,Номенклатура в биологии, Номенклатура в ботанике, Номенклатура в зоологии, Номенклатура анатомическая, Номенклатура в микробиологии).
22. Водородная связь- вид химической связи типа А - Н...А'; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.), и неподеленной парой электронов другого атома А' (обычно O, N). Атомы А и А' могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства многих синтетических полиамидов, белков, нуклеиновых кислот и др. Водородная связь - это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной. Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент - фтор, кислород, азот, реже хлор, сера. Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной. Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15-20 раз). Тем не менее, она ответственна за ассоциацию молекул. Например, образование димеров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:
H - O....H - O | | H H (H2O)2
O....H - O // \ CH3 - C C - CH3 \ // O - H....O (CH3COOH) 2 Как видно из этих примеров, посредством водородной связи объединены две молекулы воды, а в случае уксусной кислоты - две молекулы кислоты с образованием циклической структуры.
Рассмотрим образование водородной связи на примере воды. Здесь водород оказывается одновременно стянутым к кислороду второй молекулы:
![]()
водород второй молекулы стянут к кислороду третьей молекулы и т д.:
![]()
Водородную связь обозначают тремя точками.
Рассмотренный на примере воды вид водородной связи называется межмолекулярной водородной связью.
Образование водородных связей играет важную роль, как в химических, так и в биологических системах. Существование водородных связей в воде чрезвычайно важно для биологических процессов, так как свойства воды (температура кипения и кристаллизации) в значительной мере определяются наличием системы связей О–Н...О–Н. Благодаря водородным связям вода имеет температуру кипения гораздо выше, чем следовало бы ожидать по ее молекулярной массе, а температура плавления воды почти на 200° С превышает ожидаемую на основании ее молекулярной массы.
25.Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
-
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
-
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если
реакцию проводят при стандартных
условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм =
101325 Па, тепловой эффект называют
стандартным тепловым эффектом реакции
или стандартной энтальпией реакции
ΔHrO.
В термохимии стандартный тепловой
эффект реакции рассчитывают с помощью
стандартных энтальпий образования.
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.Проще говоря, энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом весом Р = p S, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот =pSx = pV
H = E = U + pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
ΔH = H2 − H1
Эндотермическая дельта H > 0 Экзотермическая дельта Н < 0

Энтальпия
образования (теплота
образования), энтальпия реакции
образования данного вещества (или
раствора) из заданных исходных веществ.
Энтальпией образования химических
соединения называют энтальпию реакции
образования данного соединения из
простых веществ. В качестве простых
веществ выбирают химические элементы
в их естественном фазовом и химическом
состоянии при данной температуре. Так,
при 298 К для хлора простым
веществом служит газообразный хлор,
состоящий из молекул С12,
а для калия -
металлический калий. Энтальпия образования
твердого КСl при 298 К - это энтальпия
реакции:К(тв.) + 1/2Сl2=
КСl(тв.).Энтальпия образования КСl (тв.)
при 500 К соответствует реакции: К(жидкий)
+ 1/2Cl2 =
КСl(тв.), так как естественным фазовым
состоянием (простым веществом)
для калия становится
уже не кристалл,
а жидкость (т-ра плавления К
336,66 К).Энтальпия образования может быть
определена при любой температуре.
Стандартные энтальпии образования ![]() соответствуют
реакциям образования, при которых и
простые вещества, и получающееся
соединение находятся придавлении 1
атм (1,01 x 105 Па).
По определению, для всех простых веществ
при любой температуре
соответствуют
реакциям образования, при которых и
простые вещества, и получающееся
соединение находятся придавлении 1
атм (1,01 x 105 Па).
По определению, для всех простых веществ
при любой температуре ![]() =
0. Для большинства хим. соед. энтальпия
образования-
отрицат.
величины.Единицы измерения энтальпии
образования - Дж/г, Дж/моль.В термодинамике растворов
(расплавов) под энтальпией образования
понимают изменение энтальпии при
изотермо-изобарном образовании 1 моля
(1 г) раствора (расплава) данного состава
из чистых компонентов. Так, в двухкомпонентной
системе KF-A1F3 энтальпия
образования расплава 50
%-ного молярного состава соответствует
процессу: 1/2КF(жидкий)
+ 1/2А1F3(жидкий)
= КF-А1F3(расплав,
50 мол. %).
=
0. Для большинства хим. соед. энтальпия
образования-
отрицат.
величины.Единицы измерения энтальпии
образования - Дж/г, Дж/моль.В термодинамике растворов
(расплавов) под энтальпией образования
понимают изменение энтальпии при
изотермо-изобарном образовании 1 моля
(1 г) раствора (расплава) данного состава
из чистых компонентов. Так, в двухкомпонентной
системе KF-A1F3 энтальпия
образования расплава 50
%-ного молярного состава соответствует
процессу: 1/2КF(жидкий)
+ 1/2А1F3(жидкий)
= КF-А1F3(расплав,
50 мол. %).
26.

27Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом весом Р = p S, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот =pSx = pV
H = E = U + pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
ΔH = H2 − H1
Изменение энтальпии (или Тепловой эффект химической реакции) не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда ΔH = 0, или же
Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы, состоящей из многихэлементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит и количествоинформации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Энтропия в информатике — степень неполноты, неопределённости знаний.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Величину DG того или иного процесса в стандартных условиях можно рассчитать, используя ее свойство функции состояния. Для реакции, протекающей по уравнению:
aA + bB = pP + qQ
|
G°(298 К) = [pfG°(298 К, P) + qfG°(298 К, Q)] – [afG°(298 К, A) + bfG°(298 К, B)] |
(4.18). |
где fG(298 К) – стандартная энергия Гиббса образования сложного вещества. Под стандартной энергией Гиббса образования fG(298 К) понимают изменение энергии Гиббса в реакции образования 1 моль сложного вещества из простых веществ в стандартных условиях (T = 298,15 K, p = 101,3 кПа). Для простых веществ, устойчивых в стандартных условиях, fG(298 К) = 0. Для многих веществ величины fG(298 К) являются справочными.
Изменения стандартной энергии Гиббса fG(298 К) в реакции может быть рассчитано также по уравнению (4.15):
![]()
если известны изменения стандартных энтальпии и энтропии химической реакции, а также температура.
25.
Энтальпия H = U + pV – термодинамическая функция, которая учитывает возможность совершения системой механической работы (pV).
Если реакция происходит при постоянном давлении, то тепловой эффект связан с изменением энтальпии системы:
Q = - ∆H = H1 – H2, где Н1 – общая энтальпия исходных веществ, а Н2 – энтальпия продуктов реакции.
Так как многие химические реакции происходят при постоянном давлении, то под тепловым эффектом обычно понимают изменение энтальпии в химической реакции, ∆H.
Тепловой эффект химической реакции. Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции. При постоянном давлении – это H – энтальпия реакции. В стандартных условиях H0.
28. Экзо-, эндотермические реакции.
Экзотермическими реакциями называют такие реакции, при которых происходит выделение теплоты. H < 0.
Эндотермическими реакциями называют такие реакции, при которых происходит поглощение теплоты. H >0.
29. Закон Гесса. Приведите примеры расчетов теплового эффекта химической реакции. Следствия из закона Гесса.
Закон Гесса: тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Пример. С(ТВ) + ½ О2(г) = СО(г), H1= -110 кДж,
СО(г) + ½ О2(г) = СО2(г), H2= -283 кДж,
С(ТВ) + О2(г) = СО2(г), H3 = H1 + H2 = -393 кДж.
Для расчета тепловых эффектов химических реакций используют следствия из основного закона термохимии – закона Гесса.
Следствие 1. Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов). Для реакции вида aA + bB = cC + dD тепловой эффект равен
H = с *Hобр(С) + d *Hобр(D) - a *Hобр(A) – b *Hобр(B).
Теплота образования Hобр – это тепловой эффект образования одного моля соединения из простых веществ при заданных условиях.
Следствие 2. Тепловой эффект химической реакции
aA + bB = cC + dD равен разности теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов): H = a *Hобр(A) + b *Hобр(B) – с *Hобр(С) – d *Hобр(D).
Теплота сгорания – это теплота реакции полного окисления одного моля вещества. Это следствие обычно используют для расчетов органических реакций.
Следствие 3. изменение энтальпии в химической реакции равно разности энергий разрываемых и образующихся химических связей.
Энергия связи А-В – это энергия, необходимая для разрыва связи и разведения образующихся частиц на бесконечное расстояние: АВ(г)→А(г)+В(г).
Энергия связи всегда положительна.