
- •ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
- •ПРОГРАММА
- •ВВЕДЕНИЕ
- •I. СТРОЕНИЕ ВЕЩЕСТВА
- •1. Строение атомов и систематика химических элементов
- •2. Химическая связь
- •3. Типы взаимодействия молекул. Конденсированное состояние вещества
- •II. Общие закономерности химических процессов
- •III. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- •2. Простые соединения химических элементов
- •3. Комплексные соединения
- •4. Органические соединения
- •IV. РАСТВОРЫ И ДРУГИЕ ДИСПЕРСНЫЕ СИСТЕМЫ. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •2. Водные растворы электролитов
- •3. Твердые растворы
- •4. Гетерогенные дисперсные системы
- •5. Электрохимические процессы
- •6. Коррозия и защита металлов
- •1. Общие свойства металлов и сплавов
- •2. Получение металлов
- •3. Легкие конструкционные металлы
- •4. Металлы групп ванадия, хрома и марганца
- •5. Металлы семейства железа и меди
- •6. Металлы групп цинка, галия и германия
- •8. Кремний, германий, сурьма, полупроводниковые материалы
- •9. Органические полимерные материалы
- •Б. ДЛЯ ИНЖЕНЕРОВ-ЭНЕРГЕТИКОВ
- •1. Химия конструкционных и электротехнических материалов
- •2. Полимерные материалы в энергетике и электротехнике
- •4, Химия воды и топлива
- •5. Химия и охрана окружающей среды
- •6. Ядерная химия. Радиохимия
- •В. ДЛЯ ИНЖЕНЕРОВ-СТРОИТЕЛЕЙ
- •1. Химия воды
- •2. Щелочно-земельные металлы и алюминий
- •3. Переходные металлы
- •4. Элементы группы углерода
- •5. Неорганические вяжущие вещества
- •6. Органические полимеры
- •ЛИТЕРАТУРА
- •Основная
- •Дополнительная
- •КОНТРОЛЬНЫЕ ЗАДАНИЯ
- •Контрольные вопросы
- •Строение атома
- •Контрольные вопросы
- •Периодическая система элементов Д.И. Менделеева
- •Контрольные вопросы
- •Химическая связь и строение молекул. Конденсированное состояние вещества
- •Контрольные вопросы
- •Энергетика химических процессов (термохимические расчеты)
- •Контрольные вопросы
- •Химическое сродство
- •Контрольные вопросы
- •Химическая кинетика и равновесие
- •Контрольные вопросы
- •Способы выражения концентрации раствора
- •Контрольные вопросы
- •Свойства растворов
- •Контрольные вопросы
- •Ионно-молекулярные (ионные) реакции обмена
- •Контрольные вопросы
- •Гидролиз солей
- •Контрольные вопросы
- •Контрольные вопросы
- •Электронные потенциалы и электродвижущие силы
- •Контрольные вопросы
- •Электролиз
- •Контрольные вопросы
- •Коррозия металлов
- •Контрольные вопросы
- •Комплексные соединения
- •Контрольные вопросы
- •Жесткость воды и методы ее устранения
- •Контрольные вопросы
- •Таблица вариантов контрольных заданий
- •Приложение
- •Оглавление

ПРИЛОЖЕНИЕ
Таблица 9.
КОНСТАНТЫ И СТЕПЕНИ ДИССОЦИАЦИИ НЕКОТОРЫХ СЛАБЫХ ЭЛЕКТРОЛИТОВ
|
|
ЧИСЛОВЫЕ |
СТЕПЕНЬ |
||
ЭЛЕКТРОЛИТЫ |
ФОРМУЛА |
ЗНАЧЕНИЯ |
ДИССОЦИАЦИИ В |
||
КОНСТАНТ |
0,1 Н. РАСТВОРЕ, |
||||
|
|
||||
|
|
ДИССОЦИАЦИИ |
% |
||
Азотистая кислота |
HNO2 |
К = 4,0 10-4 |
6,4 |
||
Аммиак (гидроксид) |
NH4OY |
К = 1,8 10-5 |
1,3 |
||
Муравьиная кислота |
HCOOH |
К = 1,76 10-4 |
4,2 |
||
|
|
К1 = 5,8 10-10 |
|
||
Ортоборная кислота |
H3BO3 |
К2 = 1,8 10-13 |
0,007 |
||
|
|
К3 = 1,6 10-14 |
|
||
|
|
К1 = 7,7 10-3 |
|
||
Ортофосфорная кислота |
H3PO4 |
К2 = 6,2 10-8 |
27 |
||
|
|
К3 = 2,2 10-13 |
|
||
Сернистая кислота |
H2SO3 |
К1 = 1,7 10-2 |
20,0 |
||
К2 = 6,2 10 |
-8 |
||||
|
|
|
|
||
Сероводородная кислота |
H2S |
К1 = 5,7 10-8 |
0,07 |
||
К2 = 1,2 10 |
-15 |
||||
|
|
|
|
||
Синильная кислота |
HCN |
К = 7,2 10-10 |
0,009 |
||
Угольная кислота |
H2CO3 |
К1 = 4,3 10-7 |
0,17 |
||
К2 = 5,6 10 |
-11 |
||||
|
|
|
|
||
Уксусная кислота |
CH3COOH |
К = 1,75 10-5 |
1,3 |
||
Фтороводородная кислота |
HF |
К = 7,2 10-4 |
8,5 |
||
Хлорноватистая кислота |
HClO |
К = 3,0 10-8 |
0,05 |
||
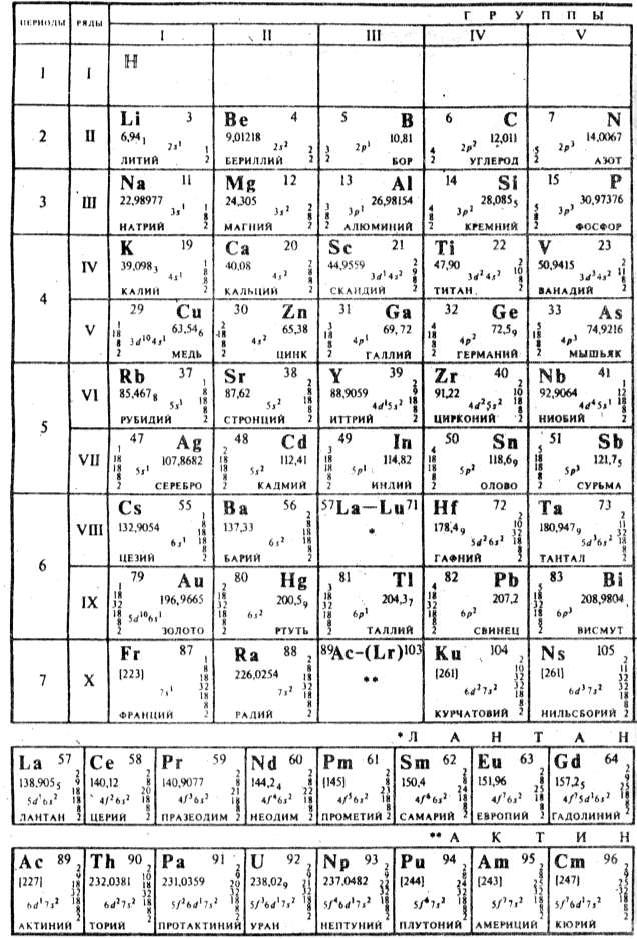
Таблица 10. |
ПЕРИОДИЧЕСКАЯ СИСТЕМА |

ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА

|
ПЕРИОДИЧЕСКАЯ СИСТЕМА |
Таблица 11. |
(вариант |

ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА длинной формы)

84
Таблица 12.
РАСТВОРИМОСТЬ СОЛЕЙ И ОСНОВАНИЙ В ВОДЕ (Р – РАСТВОРИМОЕ, М – МАЛОРАСТВОРИМОЕ, Н – ПРАКТИЧЕСКИ НЕРАСТВОРИМОЕ ВЕЩЕСТВО, ПРОЧЕРК ОЗНАЧАЕТ, ЧТО ВЕЩЕСТВО
НЕ СУЩЕСТВУЕТ ИЛИ РАЗЛАГАЕТСЯ ВОДОЙ)
|
|
|
|
|
|
|
|
|
|
|
|
|
КАТИОНЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
АНИОНЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
Na+, |
+ |
Cu |
2+ |
+ |
2+ |
Ca |
2+ |
Sr |
2+ |
Ba |
2+ |
Zn |
2+ |
2+ |
3+ |
Sn |
2+ |
2+ |
Bi |
3+ |
Cr |
3+ |
Mn |
2+ |
Fe |
3+ |
Fe |
2+ |
||
|
Li |
K |
+ |
NH 4 |
|
Ag |
Mg |
|
|
|
|
Hg |
Al |
|
Pb |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Cl– |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
– |
Р |
Р |
|
Р |
Р |
|||||||||||
Br– |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
М |
– |
Р |
Р |
|
Р |
Р |
|||||||||||
I– |
Р |
Р |
Р |
– |
Н |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Н |
– |
Р |
Р |
|
– |
Р |
|||||||||||
NO–3 |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
– |
Р |
Р |
Р |
– |
|
Р |
Р |
|||||||||||
CH3COO– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
– |
Р |
– |
– |
Р |
|
– |
Р |
|||||||||||
S2– |
Р |
Р |
Р |
Н |
Н |
– |
Р |
Р |
Р |
Н |
Н |
– |
Н |
Н |
Н |
– |
Н |
Н |
Н |
||||||||||||
SO2–3 |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
– |
– |
Н |
Н |
– |
Н |
– |
Н |
||||||||||||
SO2–4 |
Р |
Р |
Р |
Р |
М |
Р |
М |
Н |
Н |
Р |
– |
Р |
Р |
Н |
– |
Р |
Р |
|
Р |
Р |
|||||||||||
CO2–3 |
Р |
Р |
Р |
– |
Н |
Н |
Н |
Н |
Н |
Н |
– |
– |
– |
Н |
Н |
– |
Н |
– |
Н |
||||||||||||
SiO2–3 |
Р |
Р |
– |
– |
– |
Н |
Н |
Н |
Н |
Н |
– |
Н |
– |
Н |
– |
– |
Н |
Н |
Н |
||||||||||||
Cr2–4 |
Р |
Р |
Р |
Н |
Н |
Р |
М |
М |
Н |
Н |
Н |
– |
– |
Н |
Н |
Р |
Н |
– |
– |
||||||||||||
PO3–4 |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
||||||||||||
OH– |
Р |
Р |
Р |
Н |
– |
Н |
М |
М |
Р |
Н |
– |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
||||||||||||
|
|
|
Таблица 13. |
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ |
|||
|
|
|
|
ВЕЩЕСТВА |
КЛАССИФИКАЦИЯ ВЕЩЕСТВ |
П Р И М Е Р Ы |
|
|
|
s-элементы |
|
|
|
p-элементы |
|
|
Металлы |
Al, Ga, In, Ti, Ge, Sn, |
|
|
(85 элементов) |
Bi. |
|
|
|
d-элементы |
|
Простые |
|
f-элементы |
|
|
s-элементы (Н, Не) |
|
|
|
|
|
|
|
|
p-элементы |
|
|
Неметаллы |
B, C, Si, N, P, O, S, Se, |
|
|
(22 элемента) |
Te |
|
|
|
галогены |
|
|
|
благородные газы |
|
|
|
гидриды |
LiH, NaH, CaH2, BaH2 |
|
|
карбиды |
Be2C, CaC2, Al4C3 |
|
Бинарные |
нитриды |
Na3N, Mg3N2, Si3N4 |
|
оксиды |
Na2O, CaO, Al2O3 |
|
|
соединения |
||
|
сульфиды |
K2S, ZnS, Fe2S3 |
|
|
|
||
|
|
галиды |
NaCl, BaCl2, FeCl3 |
Сложные |
|
Средние |
NaNO3, Al2(SO4)3, K3PO4 |
|
Соли |
кислые (гидро-) |
NaHSO4, KH2PO4, Ca(H2PO4)2 |
|
основные (гидроксо-) |
MgOHCl, (CuOH)2SO4, |
|
|
|
||
|
|
|
Fe(OH)2Cl |
|
|
кислоты |
HNO3, H2SO4, H3PO4 |
|
Гидроксиды |
амфолиты |
Zn(OH)2, Al(OH)3, Be(OH)2 |
|
(амфотерные) |
H2ZNO2, H3AlO3, H2BeO2 |
|
|
|
||
|
|
основания |
KOH, Ba(OH)2, Ni(OH)3 |
85
ВЗАИМОСВЯЗЬ ПРОСТЫХ ВЕЩЕСТВ, ОКСИДОВ, ОСНОВАНИЙ И КИСЛОТ
(РЕАКЦИИ СОЛЕОБРАЗОВАНИЯ)
1. Металл + кислота соль + водород
Fe + 2HCl = FeCl2 + H2
2. Металл + неметалл соль бескислородной кислоты
2Fe + 3Cl2 = 2FeCl3
3. Металл (1) + соль (1) соль (2) + металл (2)
Fe + CuCl2 = FeCl2 + Cu
4. Основной оксид + кислотный оксид соль
BaO + SO3 = BaSO4
5. Основной оксид + кислота соль + вода
BaO + 2HCl = BaCl2 + H2O
6. Основание + кислота соль + вода (реакция нейтрализации)
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
7. Основание + кислотный оксид соль + вода
Ba(OH)2 + SO3 = BaSO4 + H2O
8. Основание (1) + соль (1) соль (2) + основание (2)
Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
9. Соль (1) + кислота (1) соль (2) + кислота (2)
BaCl2 + H2SO4 = BaSO4 + 2HCl
10. Соль (1) + соль (2) соль (3) + соль (4)
BaCl2 + K2SO4 = BaSO4 + 2KCl
86
