
3.5.3. Кинетика ионного обмена
Механизм ионообменного процесса включает следующие стадии:
1) диффузия ионов, поглощаемых ионитом из сплошной фазы раствора электролита к пленке раствора, непосредственно прилегающей к зерну ионита,
2) диффузия поглощаемых ионов к поверхности зерна через пленку раствора, в которой не происходит перемешивания,
3) диффузия поглощаемых ионов к месту расположения функциональных групп в объеме зерна,
4) акт обмена поглощаемых ионов на противоионы ионита,
5) диффузия вытесняемых ионов в объеме зерна к поверхности,
6) диффузия вытесняемых ионов через пленку,
7) диффузия вытесняемых ионов в объем раствора.
Ионный обмен, в целом, является хемосорбционным процессом: обменные химические реакции внутри ионитов обычно идут со скоростями значительно большими, чем диффузия ионов, наиболее медленными, а следовательно, определяющими общую скорость процесса являются стадии 2, 6 – пленочная диффузия и стадии 3, 5 – гелевая диффузия. На скорость ионного обмена значительное влияние оказывает концентрация раствора электролита. Взаимодействия между электролитами с низкой концентрацией поглощаемых ионов в растворе (менее 0,003 моль/л) и ионитами с большой обменной емкостью при малой степени сшивки, скорость обмена контролируется внешней (пленочной) диффузией. В переходной области существует смешанная кинетика, где учитываются обе диффузионные стадии. В концентрированных растворах (более 0,1 моль/л) и больших степенях сшивки процесс лимитируется диффузией ионов в зерне и описывается гелевой кинетикой. Наиболее простой и надежный метод экспериментального определения лимитирующей стадии – метод прерывания ионного обмена. При гелевой кинетике после перерыва начальная скорость обмена выше, чем до перерыва, так как концентрация в зерне выравнивается и начальный градиент концентраций возрастает. В случае пленочной кинетики кривая поглощения не имеет перегиба.
Закономерности пленочной кинетики
При пленочной кинетике скорость ионообменного процесса описывается уравнением первого закона Фика. Для зерна сферической формы
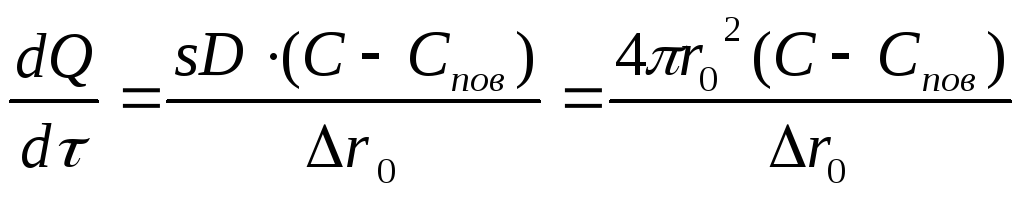
(3.5.11)
где Q – количество сорбированного противоиона; rо – радиус частицы смолы; rо - толщина пленки (эффективная толщина диффузионного слоя); С – концентрация сорбируемого противоиона в растворе; Спов – концентрация сорбируемого противоиона в растворе на границе с поверхностью ионита.
Общее количество противоиона , сорбированного зерном
Q = 4/3 rо3C¯,
(3.5.12)
где C¯– концентрация противоиона в смоле.
Если допустить, что раствор на поверхности раздела находится в равновесии с ионитом, то концентрацию в ионите С можно представить как функцию Спов. При постоянном коэффициенте распределения
(![]() 3.5.13)
3.5.13)
Подставляя полученное выражение вместо Спов в уравнение (3.5.11) , получаем
dQ/d = ( 4 rо 2D)[C – Q/(4/3 rо3)] = [3D/( rоrо )] (4/3 rо3C - Q).
(3.5.14)
При равновесии количество сорбированного противоиона определяется уравнением
Q = 4/3 rо3C,
(3.5.15)
поскольку при насыщении Спов = С, то с учетом выражения Спов = С¯/ получаем С¯ = С.
Обозначив К = 3D/( rоrо ), получаем
dQ/d = K(Q -Q),
(3.5.16)
и проинтегрировав это уравнение при начальном условии Q = 0 при = 0, получаем
F() = Q/ Q = 1 – exp(-K),
(3.5.17)
где F() – относительная доля сорбированного иона от равновесного значения.
В результате логарифмирования и преобразования уравнения получаем
lg(1-F) = - K/2,3.
(3.5.18)
