
3.5.2. Равновесие ионного обмена
Ионный обмен, как любая химическая реакция, подчиняется общим термодинамическим законам равновесия. Проникновение воды в зерно ионита вызывает диссоциацию ионогенных групп, которая меньше, чем в растворе, однако достаточна для того, чтобы ион мог свободно диффундировать, поэтому матрицу можно рассматривать как аналог иона в растворе электролита. Таким образом, при контакте раствора электролита с ионитом происходит ионный обмен, который протекает до достижения равновесия. Реакция протекает обратимо в эквивалентных соотношениях. В общем виде реакция обмена ионов А и В описывается уравнением
RA + BX RB + AX,
или в ионном виде с учетом заряда ионов
(![]() 3.5.1)
3.5.1)
где zA иzB - заряды ионов А и В, фаза ионита отмечена сверху чертой.
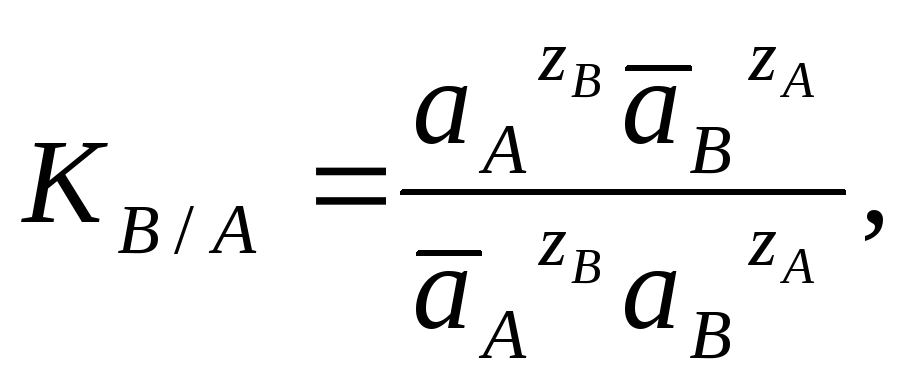 Для
этой реакции по закону действующих масс
константа термодинамического равновесия
выражается следующим образом:
Для
этой реакции по закону действующих масс
константа термодинамического равновесия
выражается следующим образом:
(3.5.2)
где āА, āВ и аА, аВ - активности ионов в ионите и растворе.
С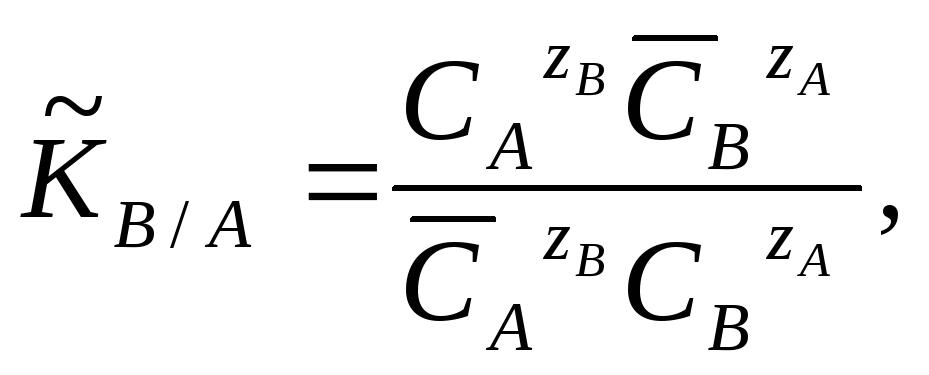 ведения
о коэффициентах активностей ионов в
многокомпонентных растворах весьма
ограничены, а методы определения
коэффициентов активностей ионов в
составе набухших ионитов пока вообще
отсутствуют. Поэтому термодинамическую
константу используют при теоретическом
обсуждении ионообменного равновесия.
Для расчета ионообменных равновесий
на практике пользуются кажущейся
(концентрационной) константой, полученной
по экспериментальным данным, ее называют
такжеконстантой обмена:
ведения
о коэффициентах активностей ионов в
многокомпонентных растворах весьма
ограничены, а методы определения
коэффициентов активностей ионов в
составе набухших ионитов пока вообще
отсутствуют. Поэтому термодинамическую
константу используют при теоретическом
обсуждении ионообменного равновесия.
Для расчета ионообменных равновесий
на практике пользуются кажущейся
(концентрационной) константой, полученной
по экспериментальным данным, ее называют
такжеконстантой обмена:
(3.5.3)
г![]() де
ĊА, ĊВи СА, СВ
- молярные концентрации ионов
в ионите и растворе.
де
ĊА, ĊВи СА, СВ
- молярные концентрации ионов
в ионите и растворе.
Численное значение концентрационной константы зависит от единиц, в которых выражены концентрации. Эта константа является безразмерной величиной при выражении равновесных концентраций в молярных долях или для реакций между ионами с одинаковыми зарядами независимо от выбора единиц концентраций.
Для описания состояния равновесия кроме констант ионного обмена на практике применяют коэффициент распределенияDи коэффициент разделения (селективности, избирательности) ТВ/А.
К![]()
![]() оэффициент
распределения равен отношению концентраций
обмениваемых ионов в ионите и в
растворе: (3.5.4)
оэффициент
распределения равен отношению концентраций
обмениваемых ионов в ионите и в
растворе: (3.5.4)
К![]() оэффициент
разделения равен отношению коэффициентов
распределения обмениваемых ионов:
оэффициент
разделения равен отношению коэффициентов
распределения обмениваемых ионов:
(3.5.5)
При равных зарядах обмениваемых ионов концентрационная константа равновесия и коэффициент разделения равны, а при обмене разнозарядных ионов они могут существенно различаться. Селективность - важное свойство ионита, характеризующее его способность к разделению ионов и способность селективно поглощать отдельные ионы или группы ионов из их смеси. Некоторые иониты проявляют высокую избирательность по отношению к какому-либо одному иону по сравнению с многими другими. В этом случае говорят о специфичности ионита, которая связана с особенностями чисто химического взаимодействия ионита с ионом.
При ТВ/А1 ионит селективен к иону В по сравнению с ионом А, а при ТВ/А1 избирательно сорбируется ион А. Если коэффициент селективности равен единице, то ионит не избирателен ни к одному из ионов и их разделить нельзя. С точки зрения термодинамики ионит будет селективен по отношению к иону В по сравнению с ионом А в том случае, если разность изменения энергии Гиббса при переходе ионов В и А из внешнего раствора в ионит меньше нуля:
(![]() 3.5.6)
3.5.6)
где G иG-разности энергий Гиббса ионов во внешнем или внутреннем растворе и идеальном растворе.
Изменение энергии Гиббса при переходе ионов из внешнего раствора во внутренний определяется двумя основными факторами: различием энергии гидратации ионов и энергией электростатического взаимодействия их с ионами противоположного знака (фиксированными ионами во внутреннем растворе, коионами во внешнем растворе). На основании сопоставления этих величин и общего изменения энергии Гиббса при переходе ионов из внешнего раствора во внутренний предложены ряды селективности для катионитов и анионитов. При составлении рядов учитывается, что электростатическое взаимодействие между ионами во внутреннем электролите выражено в большей степени, чем во внешнем растворе. Это обусловлено меньшей степенью гидратации ионов в концентрированном растворе фазы ионита, меньшим средним расстоянием между ионами и более низким значением диэлектрической проницаемости.
Ряды селективности катионов
В зависимости от вида фиксированных ионов и обменивающихся катионов экспериментально установлены различные ряды селективности катионов.
При обмене на сильнокислотном сульфокатионите однозарядных ионов установлен следующий ряд селективности:
Li+ H+ Na+ NH4+ K+ Rb+ Cs+ Ag+ Tl+.
Ионный обмен двухзарядных ионов характеризуется следующим рядом:
Mg2+ Ca2+ Sr2+ Ba2+ Ra2+
Каждый последующий член ряда сорбируется более селективно, чем предыдущий. Определяющим фактором этих рядов селективности служит изменение энергии гидратации. Поскольку энергия гидратации уменьшается с увеличением размеров ионов, то избирательность сульфокатионита к катионам возрастает с увеличением их радиуса. Электростатическое взаимодействие в данном случае мало влияет на селективность обмена, поскольку фиксированный сульфоанион имеет большой размер и слабое силовой поле.
Для разнозарядных катионов селективность растет с возрастанием заряда. В этом случае преобладающее влияние на селективность оказывает электростатическое взаимодействие, которое растет с увеличением радиуса иона.
В случае слабокислотных карбоксильных и катионитов , а также смол с фосфатными группами наблюдается обратные ряды селективности катионов по сравнению с сульфокатионитом, например для щелочных металлов:
Li+ Na+ K+ Rb+ Cs+.
Эти катиониты проявляют тенденцию к большей избирательности по отношению к ионам малого радиуса, объясняется это преобладающим влиянием на селективность энергии электростатического взаимодействия. Так, например, фиксированный анион -СОО- имеет меньшие размеры, чем группа -SO3-, кроме того на один атом кислорода приходится заряд -1/2, вместо -1/3, как у сульфогруппы, оба эти фактора способствуют увеличению энергии электростатического взаимодействия.
Ряды селективности анионов
В анионитах фиксированные ионы состоят из большого числа атомов, имеют крупные размеры и положительный заряд, равный единице. Поскольку в ряде случаев приближение противоионов к фиксированным катионам пространственно затруднено, поэтому определяющую роль играет не электростатическое взаимодействие между ними, а изменение энергии гидратации анионов при переходе из внешнего раствора в ионит. Аналогично катионитам, менее гидратированнные анионы переходят из раствора в фазу ионита. Энергия гидратации ионов одинакового заряда уменьшается с увеличением радиуса иона, что объясняет ряд селективности поглощения однозарядных ионов на высокоосновным анионитом
OH- F- HCOO- Cl- HSO3- Br- NO3- HSO4- I- ClO4-.
Кроме того, крупные анионы в большей степени нарушают структуру воды, чем анионы меньшего размера. Вследствие этого, выгоднее более выгоден их переход в фазу смолы, где структура воды менее упорядочена. Поэтому, при одинаковом заряде анионы меньшего размера вытесняются из ионита анионами большего размера. Это объясняет высокую селективность сильноосновных анионитов в отношении крупных однозарядных ионов AuCl4-, ReO4-, MnO4-, ClO4-.
С увеличением заряда анионов селективность их поглощения понижается, так как энергия гидратации увеличивается. Степень гидратации многооатомных анионов зависит не только от размера, но и от структурных факторов, особенно от наличия гидрофильных групп, определяющих взаимодействие с молекулами воды. Ряды селективности анионов характерны для высокоосновных анионитов, данные же о сорбции на низкоосновных анионитах практически не поддаются обобщению.
Как для катионитов, так и для анионитов селективность растет с увеличением степени сшивки, уменьшающей набухание.
Изотермы ионного обмена
Задачей как аналитического, так и графического описания ионообменного равновесия заключается в изображении зависимости между составами фаз ионита и раствора. В отличие от других гетерогенных систем ионообменные системы мало чувствительны к изменению температуры, поэтому изотермы ионного обмена не относятся к строго определенной температуре, а обычно характеризуют равновесие в области температур от 15 до 30 С. Изотермы ионного обмена графически изображают зависимость между эквивалентной долей иона в ионите и эквивалентной долей его в растворе при установлении равновесия между ионами, изменяющиеся в интервале от 0 до 1, так называемая квадратная диаграмма (рис.3.5.3.). Так для системы
![]()
при равенстве зарядов ионов А и В эквивалентные доли ионов А и В в ионите составят
![]()
![]()
(3.5.7)
а эквивалентные доли их же в растворе
![]()
![]()
(![]() 3.5.8)
3.5.8)
Ñ и N - суммарные концентрации ионов в фазе ионита и в внешнем растворе соответственно.
Заменив в выражении 3.5.3 молярные концентрации на их эквивалентные доли, и принимая во внимание, что значение N в условиях квадратной диаграммы равно 1, а заряды ионов А и В равны, преобразуем его относительно иона В. В итоге получим следующее уравнение изотермы:
![]()
(3.5.9)
Форма изотермы определяется величиной концентрационной константы. При КВ/А=1 изотерма обмена представляет собой биссектрису угла, образованного осями координат, при КВ/А> 1 изотерма является кривой, лежащей выше диагонали квадрата (выпуклая кривая), если КВ/А < 1 - кривая лежит ниже диагонали (вогнутая кривая). Величина константы обмена может быть определена как отношение площадей заштрихованных прямоугольников (рис. 3.5.3):
![]()
(3.5.10)
