
111
.docБелорусский Национальный Технический Университет
Кафедра «Техническая физика»
Лаборатория Механики и молекулярной физики
Отчет
по лабораторной работе №111
«Определение отношений теплоемкостей газа»
Выполнил: студент гр. 101091-12 Стреж Е.А.
Проверил: Терехова И.Н.
Минск 2013 г.
Цель работы:
-
Изучить первое начало термодинамики.
-
Изучить теорию теплоемкостей.
-
Изучить адиабатический процесс в газе.
-
Освоить метод определения отношения теплоемкостей, и получить численное значение этого отношения.
П риборы
и принадлежности:
риборы
и принадлежности:
-
Микроманометр ММН-(5)-1.0
-
Насос ручной
-
Труба стеклянная запаянная
Схема установки:
-
К-кран
-
М-манометр
-
Н-насос
-
Б-стеклянный баллон
Математическая модель:
Полное число молекул газа можно найти по формуле:
![]() .
.
Внутренняя энергия
идеального газа U
складывается из кинетических энергий
хаотического движения молекул:
![]() .
.
Молекулярно-кинетическая теория связывает среднюю кинетическую энергию молекулы Е с температурой и числом степеней свободы i соотношением:
![]() .
.
Формула для определения удельной теплоемкости идеальных газов:
![]() .
.
Первое начало термодинамики для адиабатного процесса имеет вид:
-dU=PdV.



Работа при адиабатном процессе производится за счет изменения внутренней энергии газа:
![]()
Выполнение работы:
1. Повторим выполнение 5-7раз, данные занесем в таблицу (значения h1 не должно отличаться друг от друга более чем на 6 делений шкалы).
2. Используя рабочую формулы =(h1-h0)/(h1-h2) , вычислим ошибки измерений.
3. Вычислим среднее значение отклонения от среднего измеряемой величины.
=-i/n
4. Найдём относительную ошибку измеряемой величины
=/=![]() или 0.32%
или 0.32%
|
№ |
h1 см |
h2 см |
i |
=-i |
|
|
27 |
5 |
1.23 |
0.01 |
|
|
25 |
5 |
1.25 |
0.01 |
|
|
28 |
5 |
1.22 |
0.02 |
|
|
27,5 |
3 |
1.12 |
0.13 |
|
|
26,5 |
7 |
1.36 |
0.01 |
|
- |
- |
- |
|
|
=
=1.24![]() 0.004
при =0.42%
0.004
при =0.42%
Выводы:
-
Адиабатный процесс – это процесс, происходящий без теплообмена с окружающей средой, т.е.,Q=0.Первый закон термодинамики имеет вид:
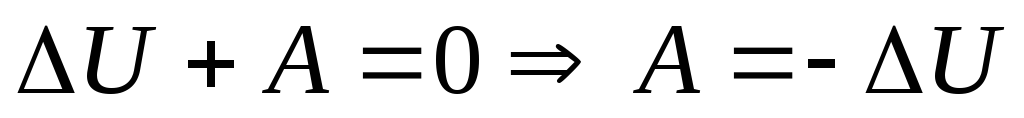 .Это
значит, что при адиабатном процессе
система может выполнять работу над
внешними телами только за счёт убыли
своей внутренней энергии. При адиабатном
расширении газ совершает работу над
окружающей средой и сам охлаждается.
Наоборот, при адиабатном сжатии А<0,
внешние силы совершают работу над газом
и газ нагревается.
.Это
значит, что при адиабатном процессе
система может выполнять работу над
внешними телами только за счёт убыли
своей внутренней энергии. При адиабатном
расширении газ совершает работу над
окружающей средой и сам охлаждается.
Наоборот, при адиабатном сжатии А<0,
внешние силы совершают работу над газом
и газ нагревается. -
Равновесный адиабатный процесс должен протекать очень медленно. На практике его осуществить нельзя, так как в природе не существует идеальных теплоизоляционных материалов.
-
Внутренняя энергия идеального газа зависит только от температуры и числа молекул.
-
При адиабатном процессе система может выполнять работу над внешними телами только за счёт убыли своей внутренней энергии.
-
При адиабатном сжатии адиабата идёт выше, чем изотерма, так как увеличение давления происходит не только за счёт уменьшения объёма (как при изотермическом сжатии), но и за счёт увеличения температуры.
