|
|
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ |
Кафедра химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для подготовки к практическим занятиям
по дисциплине
Б2.Б.4 ХИМИЯ
Модуль 3 Строение атома и химическая связь в соединениях
направление подготовки бакалавра
35.03.03 Агрохимия и агропочвоведение
Уфа - 2014
УДК
Рекомендовано к изданию методической комиссией
факультета агротехнологий и лесного хозяйства
(протокол №_______ от «______» ________________________ 2014 г.)
\
Составитель: доцент Ганиева Е.С.
Рецензент:
доцент кафедры химии Шабаева Г.Б.
Ответственный за выпуск:
заведующий кафедрой химии Ярмухамедова Э.И.
Введение
Данное методическое указание составлено для студентов 1 курса факультета агротехнологий и лесного хозяйства направления подготовки 35.03.03 Агрохимия и агропочвоведение для подготовки к практическим занятиям по дисциплине Б2.Б.4 Химия. Оно включает в себя теоретический материал и контрольные задачи по темам «Строение атома», «Периодический закон и периодическая система Д. И. Менделеева», «Химическая связь» и «Комплексные соединения». Данные задания помогут усвоить теоретический материал и подготовиться к рубежной контрольной работе по модулю 3.
3.1 Строение атома. Периодическая система элементов д.И. Менделеева
Квантово – механические представления строения атома.
В соответствии с квантово – механическими представлениями невозможно точно определить энергию и положение электрона, поэтому в квантово – механической модели атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения электрона в определенной плоскости пространства описывается волновой функцией , которая характеризует амплитуду волны, как функцию координат электрона и зависит от трех пространственных координат. Таким образом, область пространства, в которой наиболее вероятно нахождение электрона, называется орбиталью. Электрон несет отрицательный заряд, поэтому орбиталь представляет собой определенное распределение заряда, которое получило название электронного облако.
Квантовые числа.
Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n определяет энергию и размеры электронных орбиталей. Оно принимает значения 1, 2, 3, 4, 5, ….. и характеризует энергетический уровень. Чем больше n, тем выше энергия. Энергетические уровни имеют буквенные обозначения:
К n = 1
L n = 2
M n = 3
N n = 4
Q n = 5
Переходы электронов с одного энергетического уровня на другой сопровождаются выделением квантов энергии, которые могут проявиться в виде линий спектров.
Орбитальное квантовое число l определяют форму атомной орбитали и характеризует энергетические подуровни. Оно принимает значения от 0 до n – 1. Если n = 0, то электроны называются s – электронами, а орбиталь имеет сферическую форму. Если n = 1, то электроны называются p – электронами, а орбиталь принимает форму гантели или восьмерки. Если n = 2, то электроны называются d – электронами, а орбиталь принимает более сложную форму. (рис.1)
На одном и том же энергетическом уровне
энергия подуровней меняется следующим
образом: Es
< Ep
< Ed
< Ef
На первом энергетическом уровне (n = 1) один s – подуровень.
На втором (n = 2) – два: s – подуровень, p – подуровень.
На третьем (n = 3) – три: s – подуровень, p – подуровень, d – подуровень.
На четвертом (n = 4) – четыре: три: s – подуровень, p – подуровень, d – подуровень, f – подуровень.
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве. Под воздейсвием внешнего магнитного поля происходит расщепление энергии подуровней. Магнитное квантовое число принимает целочисленные значения от –l до +l, включая ноль. Соответственно, на
s – подуровне имеется одна орбиталь (ml = 0),
p – подуровне – три орбитали (ml = -1, 0, +1),
d – подуровне – пять орбиталей (ml = -2, -1, 0,1,2).
Итак, атомная орбиталь (АО) может характеризоваться тремя квантовыми числами n, l, ml.
Кроме того, каждый электрон характеризуется собственным механическим моментом движения, который получил название спина. Спиновое квантовое число ms имеет только два значения +1/2 () и -1/2 ().
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правило Гунда и Клечковского.
Принцип минимальной энергии: электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбитали.
Правило В. Клечковского (1954): Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l , а при равной сумме n + l в порядке возрастания числа n. Соответственно этому правилу подуровни выстраиваются в следующий ряд:
1s < 2s < 3s < 3p < 4s 3d < 4p < 5s 4d < 5p < 6s 4f 5d < 6p < 7s
Принцип запрета Паули (1925): В атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел n, l, ml, ms.
Правило Гунда: Электроны заполняют орбитали таким образом, чтобы их суммарный спин был максимальным.
В таблицах 1 – 6 приведены основные сведения по строению атома.
Периодический закон Д.И. Менделеева (1869): свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Наглядным выражением закона служит периодическая система элементов Д. И . Менделеева, которая состоит из периодов, групп, подгрупп, триад и семейств.
Период – горизонтальный ряд элементов, расположенный в порядке возрастания атомных масс и характеризующихся определенным заполнением определенного энергетического уровня. В этом ряду свойства элементов закономерно изменяются от типично металлических до типично неметаллических. Период заканчивается инертным газом.
Группа – вертикальный ряд элементов, имеющих одинаковое число валентных электронов, одинаковую высшую степень окисления и сходных по своим свойствам (вертикальная аналогия). Группы подразделяются на главные и побочные подгруппы.
Закономерности элементов и соединений.
В периодической системе наблюдается ряд закономерностей, связанных с возрастанием порядкового номера в периоде, группе, подгруппе, по диагонали. В частности, по главной диагонали от франция к фтору наблюдается наиболее резкое изменение свойств элементов от металлических и восстановительных к неметаллическим и окислительным. Другая диагональ: Be, Al (Ge, As), (Sn, Sb, Te), At – объединяют амфотерные металлы.
Строение атома элемента зависит от его порядкового номера (в периоде – слева направо, в группе – сверху вниз):
-
Число протонов и нейтронов в ядре возрастает в периоде, группе. Причем число нейтронов растет быстрее.
-
Общее число электронов возрастает в периоде, группе.
-
Число электронов на внешнем валентном уровне увеличивается в периоде (в малых периодах) и не меняется в группе.
-
Число энергетических уровней возрастает в группе и не меняется в периоде.
Таблица 1 Связь между главным и орбитальным квантовым числами. Число подуровней на уровне.
|
№ энергетического уровня |
1 |
2 |
3 |
4 |
… |
n |
|
Главное квантовое число n |
1 |
2 |
3 |
4 |
… |
n |
|
Орбитальное квантовое число l |
0 |
0,1 |
0,1,2 |
0,1,2,3 |
… |
0,1,2…(n-1) |
|
Подуровни |
s |
s,p |
s,p,d |
s,p,d,f |
… |
|
|
Число подуровней на уровне |
1 |
2 |
3 |
4 |
… |
n |
Вывод: число подуровней на уровне равно номеру энергетического уровня, равно числовому значению главного квантового числа n.
Таблица 2 Связь между орбитальным и магнитными квантовыми числами. Число орбиталей на подуровне.
|
Значения l |
0 |
1 |
2 |
3 |
… |
(n-1) |
|
Подуровни |
s |
p |
d |
f |
|
|
|
Значение m1 |
0 |
-1,0,+1 |
-2,-1,0,+1,+2 |
-3,-2,-1,0,+1,+2,+3 |
|
|
|
Орбитали |
– |
– – – |
– – – – – |
– – – – – – – |
|
|
|
Число орбиталей на подуровне |
1 |
3 |
5 |
7 |
… |
(2l+1) |
Таблица 3 Число орбиталей и максимальное число электронов на энергетическом уровне
|
Уровни |
Подуровни |
Число орбиталей |
Число электронов |
|
1 |
s |
1=12 |
2·12=2 |
|
2 |
s + p |
1+3=4=22 |
2·22=8 |
|
3 |
s + p + d |
1+3+5=9=32 |
2·32=18 |
|
4 |
s + p + d + f |
1+3+5+7=16=42 |
2·42=32 |
|
… |
… |
… |
… |
|
|
|
n2 |
2n2 |
Таблица 4 Максимальное число электронов на подуровне (электронная емкость подуровня)
|
Подуровень |
Число |
Электронная конфигурация завершенного подуровня |
||
|
орбиталей |
электронов |
|||
|
на подуровне |
||||
|
s |
1 |
2ē |
s2 |
|
|
p |
3 |
6ē |
p6 |
|
|
d |
5 |
10ē |
d10 |
|
|
f |
7 |
14ē |
f14 |
|
|
|
… |
… |
|
|
|
|
(2l+1) |
2(2l+1) |
|
|
Таблица 5 Количественная характеристика распределения электронов в атоме
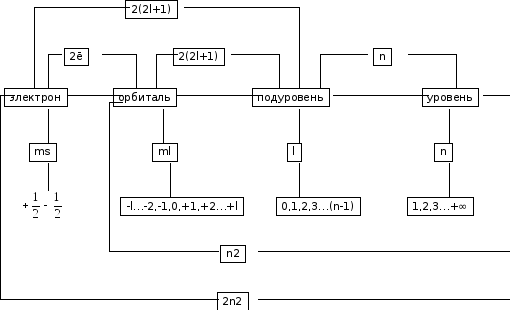
Таблица 6 Физический смысл порядкового номера элемента, номера периода, электронного семейства,
числа элементов в семействе, деления элементов на подгруппы
|
№ п/п |
В таблице ПС |
В атоме |
Связь с квантовыми числами |
|
1 |
Порядковый номер элемента Z |
Число электронов Nē и число протонов Np+ |
|
|
2 |
Номер периода |
Число энергетических уровней |
Главное квантовое число n |
|
3 |
Электронное семейство элементов: s- p- d- f- |
Заполняется электронами подуровень s- p- d- f- |
Орбитальное квантовое число l 0 1 2 3 |
|
4 |
Количество элементов в семействе: s – 2 p – 6 d – 10 f – 14 |
Максимальное количество ē на подуровне:
|
Сочетание числовых значений l, ml,ms Nē,l,max = 2(2l+1) |
|
5 |
Главные подгруппы: s-элементы р-элементы |
Заполняется внешний энергетический уровень (n=N периода):
|
|
|
6 |
Побочные подгруппы: d-элементы f-элементы |
Заполняются внутренние энергетические уровни:
|
|
Свойства атома элемента с ростом его порядкового номера тоже меняются:
-
Размер и заряд ядра увеличивается в периоде и группе.
-
Размер атома уменьшается в периоде, растет в группе.
-
Потенциал ионизации (энергия, затрачиваемая на удаление одного электрона из атома или иона) возрастает в периоде, уменьшается в группе.
-
Сродство к электрону (энергия, выделяющаяся (или поглощающаяся) при присоединении одного электрона к атому) увеличивается в периоде, уменьшается в группе.
-
Восстановительная способность элемента уменьшается в периоде, растет в группе, а окислительная способность – наоборот.
-
Электроотрицательность увеличивается в периоде и уменьшается в группе.
-
Металличность уменьшается в периоде, растет в группе, неметалличность – нооборот.
С ростом порядкового номера элемента связаны закономерности соединений:
-
Способность к образованию оксидов уменьшается в периоде, возрастает в группе (в главной подгруппе).
-
Свойства оксидов и гидроксидов в периодах изменяются от основных к амфотерным и далее к кислотным, в главных подгруппах – наоборот.
-
Высшая степень окисления элемента в оксиде возрастает в периоде, постоянна в группе.
-
Способность к образованию гидридов возрастает в периоде, уменьшается в группе.
-
Высшая валентность элемента в гидриде проходит через максимум в периоде, не изменяется в группе.
-
Способность к проявлению высшей степени окисления атома в соединении возрастает в группе.
-
Способность элементов к комплексообразованию возрастает в группе.
-
Распространенность элемента в природе, как правило, уменьшается с ростом его порядкового номера.
Руководствуясь положением элемента в периодической системе, можно охарактеризовать состав и строение элемента, а также состав и свойства образуемых элементом веществ.
Алгоритм характеристики элемента по положению его в периодической системе.
-
Электронная формула атома элемента;
-
Учитывая номер периода, тип подгруппы и число электронов на внешнем уровне, определить металличность элемента;
-
Написать электронно-структурные формулы валентного уровня атома элемента в нормальном и возбужденном состояниях;
-
Определить значения отрицательной и положительной степеней окисления для р-элементов, значения высшей и низшей положительных степеней окисления для d – элементов, значение положительной степени окисления для s – элементов;
-
Привести химическую формулу водородного соединения, дать название;
-
Привести химическую формулу оксидов и соответствующие им формулы гидроксидов с указанием их химического характера (кислотный, основной и амфотерный), назвать вещества;
-
Привести химические формулы некоторых солей и назвать их.
Характеристика р – элемента серы:
-
16S 1s22s22p63s23p4;
6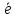

-
…3s23p4

р - элемент

неметалл
n= 3 III период

-
Нормальное состояние:
для завершения
p
– подуровня атом может принять 2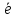
…3s23p4

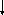

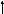
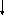
S0
+ 2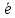 S2
S2
Отрицательную степень окисления (-2) сера проявляет в соединениях с менее электроотрицательными элементами (H, Me, P…)
-
Возбужденные состояния:
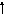
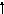
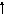
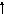


3d
S0
4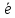 S+4
S+4
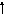
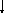
S* 3p
3s
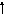

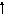
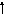

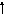
3d
S0
6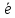 S+6
S+6
S** 3p
3s
Положительные значения степеней окисления (+4 и +6) сера проявляет в соединениях с более электроотрицательными элементами (O, F, Cl….).
-
S-2 H2S-2 – сероводород, газообразное соединение, водный раствор сероводорода является слабой кислотой ( < 2 %). Соли сероводородной кислоты называются сульфидами K2S.
-
S+4 SO2 H2SO3 соли - сульфиты
диоксид серы сернистая кислота
кислотный оксид
K2SO3 – сульфит калия
-
S+6 SO3 H2SO4 соли - сульфаты
триоксид серы серная кислота
кислотный оксид
CuSO4 – сульфат меди (II)
Открытие Периодического закона и создание Периодической системы определили развитие химии и других наук на много лет вперед. Этот закон имеет значение для понимания мира, его явлений и закономерностей.