
Khimia_konferents_nedelya
.pdf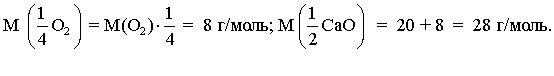
|
При проведении расчетов необходимо использовать следующие соотношения: |
|
1. |
Молярная масса эквивалента вещества X равна его молярной массе, |
|
|
умноженной на фактор эквивалентности: |
|
|
Мэкв(X) = М(X) fэкв(X). |
(2.2) |
2. |
Количество эквивалентов вещества X определяется делением его массы |
|
|
на молярную массу эквивалента: |
|
|
nэкв(X) = m(X)/Мэкв(X). |
(2.3) |
3. |
Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, |
|
|
умноженному на фактор эквивалентности: |
|
|
Vэкв(X) = V(X) fэкв(X) = 22,4 fэкв(X). |
(2.4) |
4. |
Молярная масса эквивалента сложного вещества равна сумме |
|
|
молярных масс эквивалентов составляющих это вещество атомов (ионов). |
|
5. |
Молярная масса эквивалента оксида равна молярной массе |
|
|
эквивалента элемента плюс молярная масса эквивалента кислорода: |
|
6. |
Молярная масса эквивалента гидроксида металла равна молярной |
|
массе эквивалента металла плюс молярная масса эквивалента гидроксила, например: |
|
М[½Са(ОН)2] = 20 + 17 = 37 г/моль. |
7. |
Молярная масса эквивалента сульфата металла равна молярной массе |
эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
6) Cтепень окисления – условный заряд атома в молекуле, который получает атом в
результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные, указывает на состояние окисления отдельного атома молекулы.
Правила определения степеней окисления:
-СО свободных атомов и атомов в составе простых веществ равна нулю
-В сложном веществе алгебраическая сумма СО всех атомов (с учётом индексов) равна нулю, а в сложном ионе – его заряду
-Для элементов главных подгрупп (А) ПСХЭ Д. И. Менделеева:
Высшая СО (+) = Nгруппы Низшая СО (-) = Nгруппы – 8
-Для водорода H+1
-Для фтора F-1
-Для кислорода О-2
Окислитель - это вещество или химический элемент, принимающие электроны в окислительно-восстановительной реакции. Восстановитель - это вещество или химический элемент, отдающие электроны в окислительно-восстановительной реакции.
Типы окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ

Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель,
Репропорционирование (контрдиспропорционирование) - реакция, когда в роли и окислителя, и восстановителя выступает один и тот же элемент, но в разных степенях окисления, а продуктом является вещество, содержащее этот элемент в промежуточной ст.ок.
7)Квантовые числа. Атомные орбитали, энергетические уровни и подуровни. Формы s-p-d-
орбиталей. Закономерности формирования электронных оболочек атомов: принцип наименьшей энергии, правила Клечковского, принцип Паули, правило Гунда.
Квантовые числа – энергетические параметры, определяющее состояние электрона и тип атомной орбитали на которой оно находится.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода.
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1).
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и -1/2 соответствующие противоположным направлениям вращения.
Атомные орбитали - это условные орбиты, по которым электроны вращаются вокруг ядра.
Энергетические уровни - это совокупность орбиталей, которые имеют одинаковые значения главного квантового числа. Число энергетических уровней атома равно номеру периода, в котором он расположен.
Энергетические подуровни - совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел.
l=0 s- подуровень, s- орбиталь – орбиталь сфера l=1 p- подуровень, p- орбиталь – орбиталь гантель
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
S - орбиталь

Три p – орбитали
Пять d – орбиталей
Закономерности формирования электронных оболочек атомов:
Принцип наименьшей энергии – электроны в атоме в первую очередь стремятся занять уровень и подуровень с наименьшей энергией.
Правила Кличковского : 1) Заполнение энергетических подуровней электронами происходит таким образом, чтобы сумма n+l была минимальна;
2) Если возможны два различных пути заполнения, при которых выполняется 1 правило, то реализуется тот путь, при котором минимально n.
Принцип Паули – в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел (на одной АО может располагаться не более 2 электронов с антиспиновыми числами).
Правила Гунда : 1) При прочих условиях суммарный спин системы должен быть максимальный (суммарный спин – сумма всех спиновых чисел);
2) Максимальная энергия атома достигается призаполнении электронами атомных орбиталей с минимальным значением суммы магнитных квантовых чисел.
8)Полные электронные формулы атомов и электронографические формулы
валентных электронов. Валентные возможности атомов.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Валентные возможности атомов определяются числом не спаренных электроном, а так же числом не поделённых электронных пар способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму)
9)Периодический закон и система Д.И. Менделеева. Периоды, группы, подгруппы и
семейства. Периодичность в изменении атомных радиусов, электро-отрицательности элементов, металлических, неметаллических, кислотно – основных свойств соединений.
Первоначальная формулировка: "Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса".
Современная формулировка: "Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и npподуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем nsподуровне и внутреннем
(n - 1) d- подуровне (или (n - 2) f- подуровне).
Семейства: Щелочные металлы, щелочноземельные металлы, переходные металлы, неметаллы, галогены, инертные газы, лантаноиды, актиноиды.
10. Энергия связи – это энергия, которая выделяется при образовании молекулы из
одиночных атомов или которая затрачивается на ее разрыв.
Для двухатомных молекул энергия связей равна энергии диссоциации, взятой с обратным знаком
Для многоатомных молекул с одним типом связи, например, для молекул АВn, средняя энергия связи равна 1/n части полной энергии образования соединения из атомов.
Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз (см. таблицу).
Энергии связей некоторых двухатомных молекул
Молекула |
Есв, ккал/моль |
Eсв, кДж/моль |
H2 |
103 |
430,95 |
|
|
|
Li2 |
25 |
104,6 |
|
|
|
Na2 |
17 |
71,1 |
|
|
|
K2 |
12 |
50,2 |
|
|
|
Rb2 |
11 |
46,0 |
|
|
|
Cs2 |
10 |
41,8 |
|
|
|
F2 |
36 |
150,6 |
|
|
|
Cl2 |
57 |
238,5 |
|
|
|
Br2 |
46 |
192,5 |
|
|
|
I2 |
36 |
150,6 |
|
|
|
Длина связи – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов, или из результатов определения размеров молекул с помощью числа Авогадро.
Из длин связей между атомами в молекуле можно вычислить ковалентные радиусы атомов.
Валентный угол — угол, образованный направлениями химических (ковалентных) связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома.
В большинстве случаев - чем больше энергия связи, тем меньше длина связи.
11. Ковалентная связь – это связь, образованная путем обобществления пары электронов двумя атомами.
Обменный механизм – в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону.
Донорно-акцепторный механизм – образование связи происходит за счет пары электронов атома – донора и вакантной орбитали атома акцептора.
12. Свойства ковалентной связи:
Направленность – обусловлена различными перекрыванием электронных облаков по определенным направлениям.
Насыщаемость – показывает, что атом образует не любое, а ограниченное количество связей. Их число зависит от количества неспаренных валентных электронов или свободных орбиталей.
Полярность – обусловлена неравномерным распределение электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентые связи подразделяются на неполярные и полярные.
Кратность – это количество связей образующихся между двумя атомами в молекуле.
Типы перекрывания атомных орбиталей:
-тип перекрывания ( -связь) образуется при перекрывании АО по линии, соединяющей ядра взаимодействующих атомов
-тип перекрывания ( -связь) образуется при перекрывании АО по обе стороны линии, соединяющей ядра взаимодействующих атомов
13. Образование ковалентной связи методом валентных связей - Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.
Каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Основные положения ВС
Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
14. Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d,
f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp-гибридизация (линейная)

Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация (треугольная)
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация (тетраэдрическая)
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
dsp2 (Плоскоквадратная) sp3d (Гексаэдрическая) sp3d2, d2sp3 (Октаэдрическая
15. Способы выражения концентраций растворов.
Концентрация — величина, характеризующая количественный состав раствора.
1)Массовая доля (в-ва)= m(в-ва)/m(р-ра) * 100%
2)Мольная доля N(в-ва)= n(в-ва)/n(в-ва)+n(р-ля)
3)Молярная концентрация Cм = n(в-ва)/ V(р-ра)
4)Нормальная (эквивалентная) концентрация Cn =nэкв (в-ва)/ V(р-ра) nэкв = m(в-ва)/Mэкв (в-ва)
5)Массовая концентрация Cm = m(в-ва)/ V(р-ра)
T=m(в-ва)/ V(р-ра) (титр)
6) Моляльная концентрация (мю) = n(в-ва)/m(р-ля)
