
- •Электротехническое материаловедение
- •Домены в ферро и ферримагнетиках
- •Магнитнотвердые магнетики
- •Металлы с высокой проводимостью используются при конструировонии различных электротехнических приборов и устройств Материалы, используемые как нагревательные элементы
- •Сверхпроводящие материалы (металлы, керамика)
- •Металлы
Электротехническое материаловедение
Лектор – профессор Анненков Юрий Михайлович
Лекций………….4 час
Лабораторных работ…….4час (2 работы)
Практика ……..2час
Литература
Дудкин А.Н., Ким В.С. Электротехническое материаловедение, Учебное пособие, 2009.
Дудкин А.Н., Ким В.С. Петров А.В. Электротехническое материаловедение, методическое пособие к выполнению лабораторных работ, 2007.
Разделы курса
Лекций по ЭТМ
для заочников гр. З-5А11, З-5А12, З-5А15
Химические связи в материалах
Магнитные свойства
Проводники
Полупроводники
Диэлектрики
Раздел 1
Электроотрицательность атомов
Энергетическая мера способности атома приобретать
электроны при химических взаимодействиях.
Электроотрицательные атомы, приобретая электроны,
становятся анионами, электроположительные атомы,
отдавая электроны, становятся катионами
Электроотрицательность
это полусумма потенциала ионизации
и энергии сродства атома к электрону
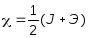 ЭВ
ЭВ
J – потенциал ионизации
Э – энергия сродства атома к электрону
Шкала электроотрицательностей атомов
Металлоиды Металлы
F – 4,1 Cu,Ni –1,75 Hg – 1,44
O – 3,5 Ga – 1,82 W – 1,42
N – 3,07 Si – 1,74 Al – 1,4
Cl –2,83 Co – 1,7 Mo – 1,3
Br – 2,74 Zn –1,66 Mg – 1,23
S –2,6 Tl – 1,64 Zr – 1,22
Se – 2,48 Mn – 1,6 Na – 1,08
I – 2,21 Cr – 1,56 Sr – 0,99
As – 2,2 In – 1,49 Li – 0,97
H –2,1 Cd – 1,46 K – 0,91
B –2,01 V – 1,45
Понятие химической связи
Это сцепление атомов в молекулы или в кристаллы
под действием электрических сил
Валентные электроны либо переходят от атома к атому,
либо обобществляются
Различают три типа химической и межмолекулярную связи:
Ионная
Ковалентная
Металлическая
Межмолекулярная связь
Критерий образования типа химической связи
 разница
электроотрицательностей атомов
разница
электроотрицательностей атомов
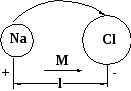
Ионная связь
(гетерополярная)
NaCl, KBr, MgO….
Δ χ большое
e-
Чисто ковалентная связь
(гомеополярная)
(Н2, О2, N2, Cl2)
Δ χ =0
объединение атомов в молекулу достигается за счёт объединеня валентных электронов в ковалентные пары







+



+
+


Н
Н
Смешанная КС (ИС + КС)
Δ χ - мало


Cl+

Н+


H – 2.1 Cl – 2.83
Металлическая связь
Δ χ =0

водородная связь
Обусловлена присутствием атомов водорода

H

ЭО
+ -
М

Межмолекулярные связи (силы Ван дер Ваальса)
Дисперсионная связь, ориентационная связь, индукционная связь
Обусловлены притяжением диполей
Значения энергии связи
|
Тип свяэи |
Ионная |
Ковалентная |
Метал лическая |
водородная
|
Межмолекулярная |
|
Энергия связи эВ/связь |
10-15 |
8-10 |
7-9 |
Около 1 эВ |
0,2-0,8 |
Основы зонной теории твердого тела
Твердое тело
атом
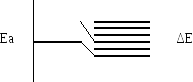
Каждый электронный уровень в атоме
расщепляется в зону разрешенных состояний
в твердом или жидком теле
В зависимости от структуры материала
зоны разрешенных состояний могут перекрываться, образуя непрерывную зону – металлы
Либо между зонами разрешенных состояний имеются запрещенные зоны – диэлектрики и полупроводники

Диэлектрик
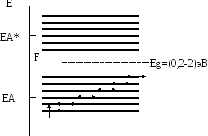
Полупроводник

Металл
Понятие дырки
Е
ЗП









ВЗ









2 Раздел
Магнитные материалы
магнитное поле
Н – напряженность магнитного поля (создается током заряженных частиц) [H]=А/m, эрстед H=I/2πR
1А/м = 0,0125 э.
Электрический ток – источник магнитного поля
Сила магнитного поля – индукция [B] = тесла, гаусс B= Ф/S
1вб/м2=104гс
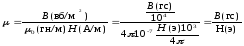
μ0 =4π.10-7 Гн/м - магнитная постоянная или магнитная проницаемость вакуума
B0= μ0 H – для вакуума
Вещество в магнитном поле
Характеристика намагичивания вещества – вектор намагничивания
J=M/V – момент единицы объема – намагниченность
[ J ]=A/m, гаус
J= χH
χ = J/H магнитная восприимчивость (безразмерная)
B= μH – для среды
μ – магнитная проницаемость среды
Магнитная проницаемость среды показывает
во сколько раз индукция магнитного поля в среде
отличается от магнитной индукции в вакууме.
Магнитные моменты атомов
определяются магнитными моментами электронов
S – орбиталь

3s

2s
1s

P – орбиталь

d – орбиталь

f – орбиталь




4d


3d








Принцип Паули
на каждом энергетическом уровне (атомной орбитале) располагается не больше двух электронов
Правило Хунда
Все атомные орбитали вначале заполняются одним электроном, затем вторым
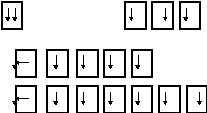
S-орбиталь Р- орбиталь
d- орбиталь
f- орбиталь
Энергетика электронных
состояний в атомах
5f
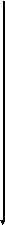
6d


6p
7s





5d

5


4f
6s



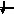
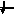
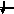
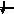
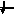
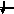
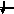
5p
O

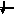
5s

N
4p


4d


4
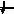

3d




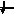
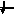
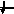
3

3p


4s
3s
M





L




2p

2









2s
1
1s
К



1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d, 5f…..
Электроны – носители магнетизма
Атомные электроны имеют две составляющие магнитного момента:
а) МОР - орбитальный,
б) МS=МБ – спиновый
Магнитный момент атома:
Ма= МS. n нск. = МБ. n нск
n нск – число нескомпенсированных электронов.
МБ – магнитный спиновой момент электрона
Магнитным моментом не обладают атомы с попарно скомпенсированными электронами
Сущность диамагнетизма
Вещества из атомов
с попарноскомпенсированными
электронными магнитными моментами
Магнитный момент равен нулю
Контур с током – модель диамагнетика
Роль контура с током выполняет движение электронов по своим орбиталям
Закон Эл. Маг. Индукции Фарадея -
основа диамагнетизма
диамагнетики выталкиваются из маг. поля
χ < 0 μ=1+ χ = 0, 99…
Все вещества – диамагнетики, но диамагнетизм
проявляется только тогда,
когда другие виды магнетизма отсутствуют
Cu, Ag, Au, Be, Zn, Ga, B, Pb, Sb,ЩГК,
сверхпроводники
Сущность парамагнетизма
Парамагнетики – вещества, у которых атомы имеют магнитный момент
χ > 0 μ=1+ χ = 1.0001…
примеры парамагнетиков
Al, O, Pt, Mg, Pd, Cr, Ca, Mo
Ферромагнетики, ферримагнетики, антиферромагнетики
Ферромагнетики - это вещества, состоящие из областей (доменов)
с магнитным моментом в отсутствии поля.
Причина намагничивания доменов –
обмен атомов d и f-электронами, которое обеспечивает
параллельную ориентацию спинов.
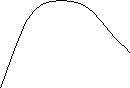
Энергия обменного взаимодействия между атомами положительна и максимальна для переходных элементов – Fe, Co, Ni, Сd
А так же редкозем. элементов Gd, Tb, Dy, Ho, Er, Tm Туллий
A

Co
Ni

Сd

Fe
r, межатомное расстояние

Условие эффективного обмена атомов d и f-электронами
соответствует Amax и выполняется для Fe, Co, Ni, Cd
При этом домен приобретает магнитный момент
в отсутствии поля за счет
параллельной ориентации спинов атомов.
Критерии ферромагнетизма:
1. Наличие внутренних незаполненных оболочек (d или f) в атомах.
2. Положительное значение интеграла обменной энергии
Антиферромагнетики
материалы, в которых
во время обменного взаимодействия соседних атомов происходит антипараллельная ориентация равных по величине магнитных моментов
Магнитная восприимчивость
χ 10-2 10-5
1,0001..
Ce, Nd, Sm, Eu, Mn, Cr
Ферримагнетики
Ферримагнетики - материалы,
у которых магнитные моментыатомов
различных подрешёток ориентируются антипараллельно,
как и в антиферромагнетиках,
но моменты различных подрешёток не равны,
и, результирующий момент не равен нулю.
Ферримагнетики характеризуются спонтанной магнетизацией.
Различные подрешётки в них
состоят из различных атомов или ионов, например,
ими могут быть различные ионы железа, Fe2+ и Fe3+.
Свойствами ферримагнетиков обладают
различные оксидные соединения,
среди которых наибольший практический интерес
представляют ферриты.
Ферримагнетики имеют доменную структуру,
состоящую из двух или более подрешеток,
связанных антиферромагнитно (антипараллельно).
Поскольку подрешетки образованы атомами
различных химических элементов
или неодинаковым их количеством,
они имеют различные по величине магнитные моменты,
направленные антипараллельно.
В результате появляется отличная от нуля
разность магнитных моментов подрешеток,
приводящая к спонтанному намагничиванию кристалла. Таким образом, ферримагнетики можно рассматривать как нескомпенсированные антиферромагнетики
(у них магнитные моменты атомов не компенсированы).
Свое название эти материалы получили от ферритов — первых некомпенсированных антиферромагнетиков.
У ферритов доменная структура, как и у ферромагнетиков, образуется при температурах ниже точки Кюри.
К ферритам применимы все магнитные характеристики, введенные для ферромагнетиков.
В отличие от ферромагнетиков они имеют
высокое значение удельного сопротивления,
меньшую величину индукции насыщения,
Ферромагнетизм в металлах объясняется
наличием обменного взаимодействия,
которое образуется между соприкасающимися атомами,
а также взаимной ориентацией спиновых магнитных моментов
В ферримагнетиках магнитные моменты ионов
ориентированы антипараллельно
и обменное взаимодействие происходит не непосредственно,
а через ион кислорода .
Такое обменное взаимодействие
называют косвенным обменом или сверхобменом.
