
Лаб раб СМ крист-ция Вопросы для теста
.docЛабораторная работа
-
Изучение процесса кристаллизации
Цель работы: Изучить процесс кристаллизации различных солей из водных растворов. Выявить закономерности роста и формирования кристаллов солей. Используя двумерную модель кристаллизации Чернова-Миркина рассмотреть кинетику кристаллизации.
Основные положения.
-
Термодинамические условия кристаллизации.
При переходе из жидкого состояния в твердое, образуется кристаллическая решетка, возникают кристаллы. Такой процесс называется кристаллизацией. В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии. С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и кристаллического состояний. Схематически характер изменения свободной энергии жидкого и твердого состояний с температурой показан на рис. 1

Рис. 1. Изменение свободной энергии жидкого (1) и кристаллического (2) состояния в зависимости от температуры
Рис. 2. Кривые охлаждения при кристаллизации
Выше температуры Ts меньшей свободной энергией обладает вещество в жидком состоянии, ниже Ts — вещество в твердом состоянии. Следовательно, выше Тs вещество должно находиться в жидком состоянии, а ниже Тs — в твердом, кристаллическом. Очевидно, что при температуре, равной Тs, свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическая температура кристаллизации.
Однако при Ts не может происходить процесс кристаллизации (плавление), так как при данной температуре Fж = Fкp и процесс кристаллизации (плавления) не может идти, так как при равенстве обеих фаз это не будет сопровождаться уменьшением свободной энергии.
Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Из кривых, приведенных на рис. 1 видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Тs. Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением.
Указанные причины обусловливают и то, что обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts ; это явление называется перенагреванием.
Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время температура (рис. 2).
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния.
При достижении температуры кристаллизации на кривой температура — время появляется горизонтальная площадка (кривая 1, рис. 2), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. По окончании кристаллизации, т. е. после полного перехода в твердое состояние, температура снова начинает снижаться, и твердое кристаллическое вещество охлаждается. Теоретически процесс кристаллизации изображается кривой 1. Кривая 2 показывает реальный процесс кристаллизации. Жидкость непрерывно охлаждается до температуры переохлаждения ТП, лежащей ниже теоретической температуры кристаллизации Ts. При охлаждении ниже температуры Тs создаются энергетические условия, необходимые для протекания процесса кристаллизации.
У некоторых металлов из-за большого переохлаждения скрытая теплота плавления выделяется в первый момент кристаллизации настолько бурно, что температура скачкообразно повышается, приближается к теоретической (кривая 3, рис. 2). Так кристаллизуется, например, сурьма.
Чем больше скорость охлаждения, тем больше величина переохлаждения. Для того, чтобы полностью переохладить металл в жидком состоянии требуются большие скорости охлаждения (миллионы и даже миллиарды градусов в секунду), такой металл называется аморфным или металлическим стеклом.
-
Механизм кристаллизации по Чернову-Тамману.
Еще в 1878 г. Д. К. Чернов, изучая структуру литой стали, указал, что процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые Чернов называл «зачатками», а теперь их называют зародышами, или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров.
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов. Обе эти величины можно измерить для разных условий кристаллизации.
Рис. 3 Кинетическая
кривая кристаллизации
Рис. 4 Скорость
роста кристаллов и скорость зарождения
центров кристаллизации в зависимости
от степени переохлаждения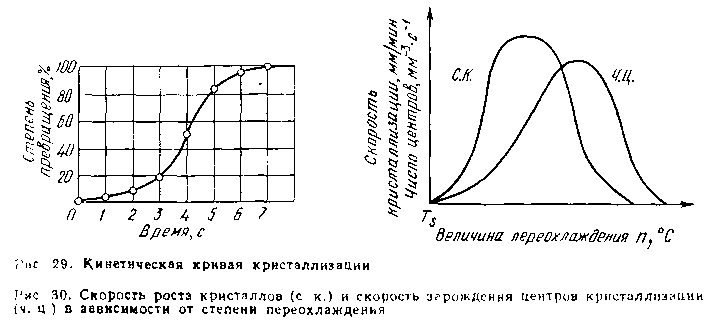
Исследуя кристаллизацию прозрачных органических веществ при разных температурах, Г. Тамман установил, что ч. ц. и с. к. определяются степенью переохлаждения. Графически изменения величин ч. ц. и с. к. в зависимости от переохлаждения представлены на рис. 4. Зависимость ч. ц. н с. к. от переохлаждения выражается кривой с максимумом. При теоретической температуре кристаллизации (п = 0) значения с. к. и ч. ц. равны нулю и процесс кристаллизации идти не может, что находится в полном соответствии о необходимости переохлаждения для протекания процесса. С увеличением переохлаждения значения с. к. и ч. ц. возрастают, достигают максимума и затем понижаются; при больших величинах переохлаждения практически падают до нуля. При больших степенях переохлаждения с. к. и ч. ц. становятся равными нулю, так как подвижность атомов уже недостаточна для того, чтобы осуществилась перестройка их из хаотического расположения в жидкости, в правильном кристалле.
Размер образовавшихся кристаллов зависит от соотношения величин с. к. и ч. ц. при температуре кристаллизации, при данной степени переохлаждения. При большом значении с. к. и малом значении ч. ц. (например, при малых степенях переохлаждения, рис. 4), образуются немногочисленные крупные кристаллы; при малых значениях с. к. и больших ч. ц. (большое переохлаждение) образуется большое число мелких кристаллов.
-
Модель Чернова-Миркина.
 Процесс
образования кристаллов путем зарождения
центров кристаллизации и их роста
можно изучать с помощью рассмотрения
моделей (схем), что с успехом применялось
И. Л. Миркиным.
Процесс
образования кристаллов путем зарождения
центров кристаллизации и их роста
можно изучать с помощью рассмотрения
моделей (схем), что с успехом применялось
И. Л. Миркиным.
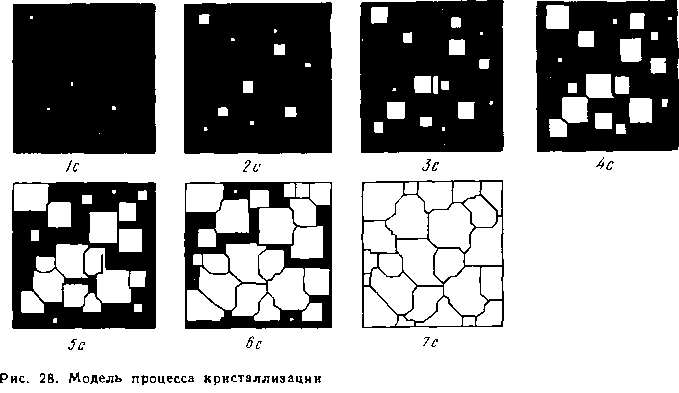
Рис. 5 Модель
процесса кристаллизации
Предположим, что на площади, изображенной на рис. 5 за секунду возникает пять зародышей, которые растут с определенной скоростью. К концу первой секунды образовалось пять зародышей, к концу второй секунды они выросли и одновременно с этим возникло еще пять новых зародышей будущих кристаллов.
 Так,
в результате возникновения зародышей
и их роста происходит процесс
кристаллизации, который, в данном
примере, заканчивается на седьмой
секунде.
Так,
в результате возникновения зародышей
и их роста происходит процесс
кристаллизации, который, в данном
примере, заканчивается на седьмой
секунде.
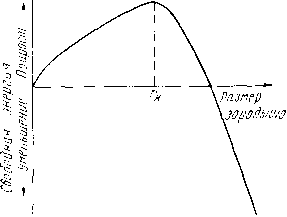
Увеличение размера зарождающегося кристалла вначале приводит к росту свободной энергии (так как объем Vмал, а поверхность S относительно велика) (рис. 6). Но при некотором критическом значении увеличение размера зародыша приведет к уменьшению свободной энергии.
Рис.
6 Изменение свободной энергии в
зависимости от размера зародыша
Минимальный размер способного к росту зародыша называется критическим размером зародыша, а такой зародыш называется устойчивым.
Каждой температуре кристаллизации (степени переохлаждения) отвечает определенный размер устойчивого зародыша; более мелкие если ОНИ И возникнут, тут же растворяются в жидкости, а более крупные растут, превращаясь в зерна — кристаллы. Чем ниже температура (больше степень переохлаждения), тем меньший размер имеет устойчивый зародыш, тем больше число центров кристаллизации образуется в единицу времени, тем быстрее протекает процесс кристаллизации. Таким образом, с увеличением степени переохлаждения быстро возрастают величина ч. ц. и общая скорость кристаллизации.
В зависимости от условий кристаллизации микроструктура металлических отличвок простой формы может быть различна; схематические представления о некоторых типах структуры даны на рис. 7.
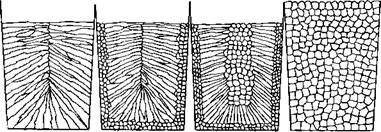
Рис.7 Возможная макроструктура слитков: А —столбчатые зерна; б —мелкие равноосные и столбчатые зерна; в — мелкие равноосные, столбчатые зерна и равноосные зерна в центре; г —равноосные зерна.
Процесс образования кристаллов путем зарождения центров кристаллизации и их роста можно изучать с помощью модели Чернова-Миркина.
Рассмотрим пример. Пусть в заданном объеме жидкой фазы за 1 секунду возникает шесть зародышей (Vзцк=6 1/сек), которые растут с линейной скоростью Vлср= 1мм/сек.
К концу первой секунды образовались шесть зародышей, к концу второй секунды они выросли и одновременно с этим возникло еще шесть новых зародышей будущих кристаллов. Так, в результате возникновения зародышей и их роста происходит процесс кристаллизации, который в данной работе заканчивается на третьей секунде.
Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента:
-
По мере развития процесса кристаллизации в нем участвует все большее и большее число кристаллов. Потому процесс в начале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов не начнет заметно препятствовать их росту, рост кристаллов замедляется, тем более, что и жидкости в которой образуются новые кристаллы становится все меньше.
-
В процессе кристаллизации пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается, внешняя форма кристалла оказывается зависимой от условий соприкосновения с соседними растущими кристаллами.
Таким образом, процесс кристаллизации количественно определяется двумя характеристиками:
Скоростью зарождения центров кристаллизации и скоростью роста кристаллов, а также результирующим параметром – степенью превращения жидкой фазы в кристаллическую для произвольно заданного времени.
Лабораторная работа № 1
Изучение процесса кристаллизации солей
-
Приборы и материалы.
Биологический микроскоп МБУ, электроплитка, водные растворы солей:
Pb(NO3)-азотнокислый свинец, K3Fe(CN)6-красная кровяная соль, KMnO4- марганцевокислый калий.
-
Задание.
А) изучить особенности процесса кристаллизации солей с помощью микроскопа; Б) зарисовать схему строения закристаллизовавшейся капли; В) провести анализ полученных результатов.
Лабораторная работа № 2
Моделирование процесса кристаллизации
Исходные данные.
А) для заданной степени переохлаждения из таблицы определить Vзцк и Vлср; Б) в качестве заданного объема взять квадрат 50х50 мм; В) принять размер критического зародыша 1х1 мм.
Задание.
А) Провести процесс кристаллизации с интервалом в 1 сек. до полного исчезновения жидкой фазы; Б) для каждого момента времени рассчитать степень превращения жидкой фазы в кристаллическую по формуле: =(mкр/mобщ)100%; В) построить график зависимости степени превращения жидкой фазы в кристаллическую от времени; Г) сделать выводы.
Контрольные вопросы
Входной контроль
-
Что такое степень переохлаждения (СП)?
-
СП – это охлаждение до температур ниже комнатной температуры (до TTкомн).
-
СП – это величина, определяемая отношением (Ts-Tохл)/t, где Ts- теоретическая температура кристаллизации, Tохл – температура, до которой охладилась жидкая фаза, t- время охлаждения.
-
СП – это разность Ts-Tохл.
-
СП – это величина, определяемая отношением (Tкр-Tкомн)/ Tкомн, где Tкр- температура кристаллизации.
-
Термодинамическое условие для самопроизвольного фазового перехода LS определяется соотношением между величиной свободной энергии L-фазы (FL) , S-фазы (FS) и их изменением при кристаллизации F= FS - FL:
-
F = 0
-
F 0
-
F 0
-
F 0
-
Главные параметры процесса кристаллизации по теории Чернова-Таммана:
-
Степень переохлаждения – Tп и время охлаждения – t.
-
Критический размер зародыша – Rкр и изменение свободной энергии – F.
-
Площадь поверхности – S и объем зародыша –v.
-
Скорость зарождения зародышей – Vзцк и линейная скорость их роста –Vлср.
-
Критический размер зародыша Rкр это :
-
Предельный размер зародыша, когда при R Rкр зародыш не растет.
-
Если R Rкр , то зародыш растет самопроизвольно.
-
Если R Rкр то образовавшийся зародыш исчезает (растворяется).
-
Когда R Rкр , то получается крупнокристаллическая структура, а при R Rкр получается мелкокристаллическая структура.
-
Механизм кристаллизации по теории Чернова-Таммана:
-
В жидкой фазе образуются зародыши, появление и рост которых определяется скоростью зарождения центров кристаллизации (Vзцк) и линейной скоростью их роста (Vлср).
-
В жидкой фазе образуются зародыши, появление и рост которых определяется степенью переохлаждения и изменением свободной энергии при превращении LS.
-
Для зарождения в жидкой фазе зародышей необходимы высокая скорость охлаждения и условие FL FS.
-
Для образования в жидкой фазе зародыша критического размера Rкр необходимо, чтобы скорости Vзцк и Vлср были больше нуля.
-
Условие образования крупнокристаллической (крупнозернистой) структуры:
-
Vзцк – низкая и Vлср – низкая.
-
Vзцк – низкая, а Vлср – высокая.
-
Vзцк – высокая, а Vлср – низкая.
-
Vзцк – высокая и Vлср – высокая.
-
Условие образования мелкокристаллической (мелкозернистой) структуры:
-
Vзцк – низкая и Vлср – низкая.
-
Vзцк – низкая, а Vлср – высокая.
-
Vзцк – высокая, а Vлср – низкая.
-
Vзцк – высокая и Vлср – высокая.
-
Правильные ответы
1 - c
2 - b
3 - d
4 - b
5 - a
6 - b
7 – c
Выходной контроль
-
Почему в одном и том же растворе соли вырастают и крупные и мелкие кристаллы?
-
Чем объясняются особенности формы кристаллов разных солей, таких как KMnO4 и K3Fe(CN)6?
-
Как зависит процесс кристаллизации капли раствора соли от ее толщины?
-
Почему в полностью закристаллизовавшейся капле встречаются кристаллы «правильной» и «неправильной» формы?
