
lecture-9
.pdf
От микроМИРА к МАКРОмир
Молекулы и химические превращения
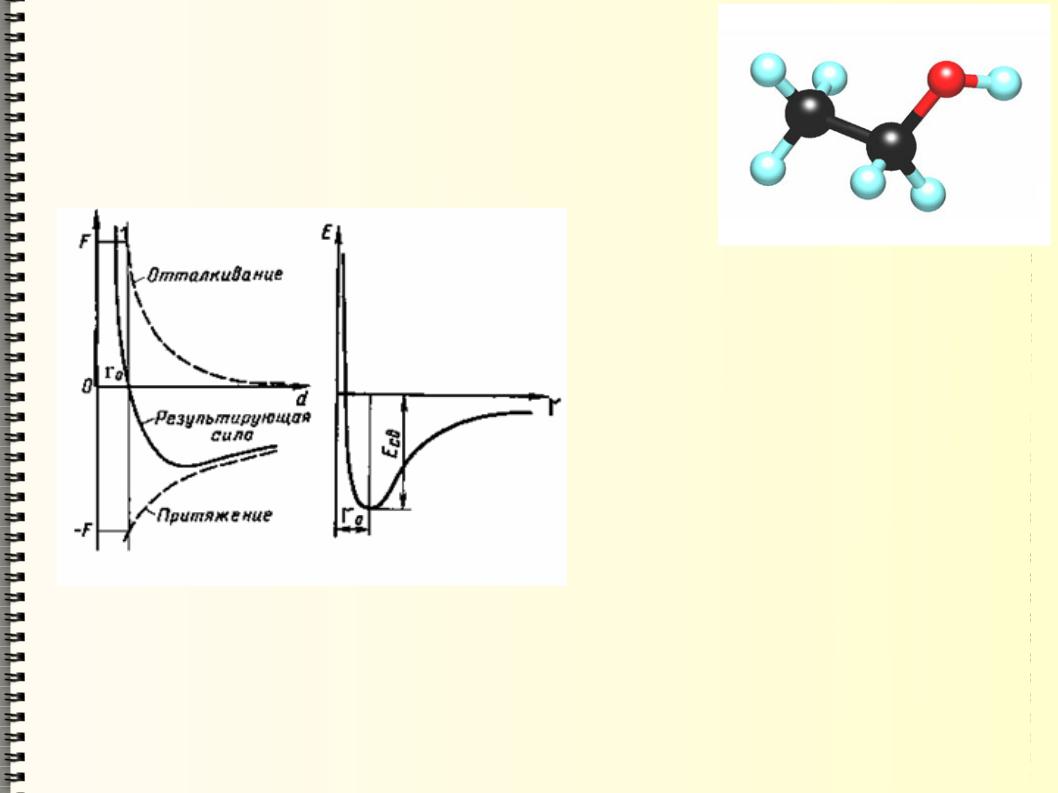
Молекула представляет собой связанное состояние некоторого числа атомов. Это становится возможным благодаря силам притяжения между атомами, имеющим электрическую природу.
Поскольку соединение атомов в молекулы происходит в результате химических реакций, соответствующие виды связей получили название химических. Опыт показывает, что химические свойства элементов полностью зависят от числа электронов на внешних оболочках их атомов — числа валентных электронов.

Виды химических связей:
1) ионная связь возникает, когда один из атомов отдает валентный электрон другому атому

2) металлическая связь возникает между атомами веществ с малым числом валентных электронов (т.е. металлов), когда в состоянии твердого тела эти электроны обобществляются, отрываясь от атомов и образуя электронный газ вокруг ионов

3) ковалентная связь возникает между атомами веществ с близкими химическими свойствами (т.е. близким числом валентных электронов)

4)полярная связь возникает благодаря взаимодействию между заряженными областями молекул
5)ван-дер-ваальсовы силы обычно характеризуют водородные связи,
возникающие между полярными молекулами или их частями

Молекулы органических веществ очень часто содержат водородные связи:
белок
триозофосфатизомераза
ДНК

Химическое взаимодействие атомов отличается от взаимодействия отдельных электрических зарядов благодаря свойству насыщения. Атомы вступают во взаимодействие только с определенным числом других атомов, после чего присоединить к молекуле еще какой-то атом уже невозможно. Именно поэтому молекулы веществ имеют четко определенный состав, хотя возможна некоторая вариабельность в порядке их размещения. Такие вещества называют изомерами – они обладают одинаковыми качественным и количественным составами, но отличаются порядком связывания атомов, т.е. химическим строением.

F F
A 

 A
A
AB |
AB |
Химические реакции можно рассматривать с точки зрения превращения энергии:
1)если при синтезе молекулы ее энергия меньше суммы энергии составляющих ее изолированных атомов, то она может существовать – ее связи устойчивы.
2)из того, что реакция возможна еще не следует, что она пойдет обязательно. Для перехода из состояния реагентов в состояние продуктов необходимо преодолеть некоторый энергетический барьер – сообщить веществам энергию, называемую энергией активации.

Исходные реагенты могут иметь низкую химическую активность. Однако при создании особых условий (подогрев, облучение, перемешивание и др.) или при внесении каталитических веществ активность реагентов повышается.
Подавляющее большинство химических реакций протекает в несколько стадий. Это обусловлено тем, что реакция инициируется путем создания тем или иным способом из уже имеющихся веществ более активных реагентов – радикалов. Затем каждый радикал вызывает целую серию последовательных реакций, пока не исчезнет. Сложные многоэтапные реакции называют цепными.
Cl2 → 2Cl
H2 + Cl2 → 2 HСl Cl + H2 → HCl +H
Cl2 + H → HCl + Cl
