
- •Ковалентная связь
- •Метод валентных связей
- •Сигма (s) и пи (p)-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •2,7 Д 2,7 д
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
Донорно-акцепторная связь
Возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония (NH4+). В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако)
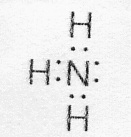
У иона водорода свободна (не запонена) 1s-орбиталь, что можно обозначить как Н+ (здесь квадрат означает ячейку). При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, то есть оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
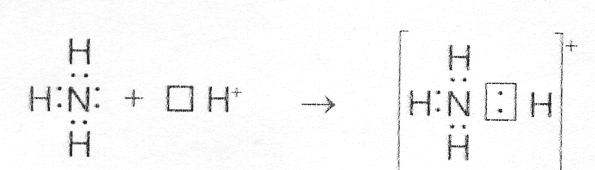
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащая азоту, становится общей с Н+. В схемах изображение ячейки часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (то есть предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертная связь N-H в ионе аммония ничем не отличается от остальных трех.
Большей частью донорами являются молекулы, содержащие атомы N, O, F, Cl связанные в ней с атомами других элементов. Акцептором может быть частица, обладающая вакантными электронными уровнями, например, атомы d-элементов, обладающие незаполненными d-подуровнями.
Свойства ковалентной связи
Длина
связи –
это межъядерное расстояние. Химическая
связь тем прочнее, чем меньше ее длина.
Длина связи в молекулах составляет:
НС3-СН3
1,54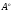 ;
Н2С=СН2
;
Н2С=СН2
1,33
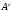 ;
НС≡СН 1,20
;
НС≡СН 1,20
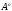 .В
пересчете на одинарные связи эти величины
увеличиваются, реакционная способность
соединений с кратными связями возрастает.
Мерой прочности связи является энергия
связи.
.В
пересчете на одинарные связи эти величины
увеличиваются, реакционная способность
соединений с кратными связями возрастает.
Мерой прочности связи является энергия
связи.
Энергия связи определяется количеством энергии, которое необходимо для разрыва связи. Обычно она измеряется в килоджоулях, отнесенных к 1 молю вещества. С увеличением кратности связи энергия связи увеличивается, а ее длина уменьшается. Величины энергии связи в соединениях (алканы, алкены, алкины): С-С 344 кДж/моль; С=С 615 кДж/моль; С≡С 812 кДж/моль. То есть энергия двойной связи меньше удвоенной энергии одинарной связи, а энергия тройной связи меньше утроенной энергии одинарной связи, поэтому алкины более реакционноспособны из этой группы углеводородов.
Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Например, атом водорода (один неспаренный электрон) образует одну связь, атом углерода (четыре неспаренных электрона в возбужденном состоянии) – не более четырех связей. Вследствие насыщаемости связей молекулы имеют определенный состав: Н2, СН4, НСl и т.д. Однако и при насыщенных ковалентных связях могут образовываться более сложные молекулы по донорно-акцепторному механизму.
Направленность ковалентной связи обусловливает пространственную структуру молекул, то есть их форму. Рассмотрим это на примере образования молекул HCl, H2O, NH3.
Согласно МВС, что ковалентная связь возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. При образовании молекулы НСl происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекулы такого типа имеют линейную форму.
На внешнем уровне атома кислорода имеются два неспаренных электрона. Орбитали их взаимно перпедикулярны, т.е. располагаются относительно друг друга под углом 90о. При образовании молекулы воды орбиталь каждого р-электрона перекрывается 1s-орбиталью атома водорода вдоль линии осей координат. Химические связи в этом случае должны быть направлены под углом 90о. Экспериментально найдено, что угол между связями в молекуле воды ے Н-О-Н = 104,5о, что объясняется частичной sр3-гибридизацией атомных орбиталей кислорода.
Таким образом, атом кислорода с двумя неспаренными (валентными) р-элект-ронами образует с водородом молекулы воды, которая имеет угловую форму. Очевидно, молекулы такой же формы должны образовывать с водородом аналоги кислорода – сера, селен, теллур.
В образовании молекулы NH3 участвуют три неспаренных р-электрона атома азота, электронные орбитали которых также взаимно перпендикулярны, и 1s-электроны трех атомов водорода.
Связи располагаются вдоль трех осей р-орбиталей. Молекула имеет форму правильной пирамиды, в углах треугольника находится атомы водорода, в вершине пирамиды – атом азота. Угол между связями ے Н-N-Н = 107,3о. Молекулы такой же формы (но с другим значением угла) образуют с водородом аналоги азота – фосфор, мышьяк, сурьма.
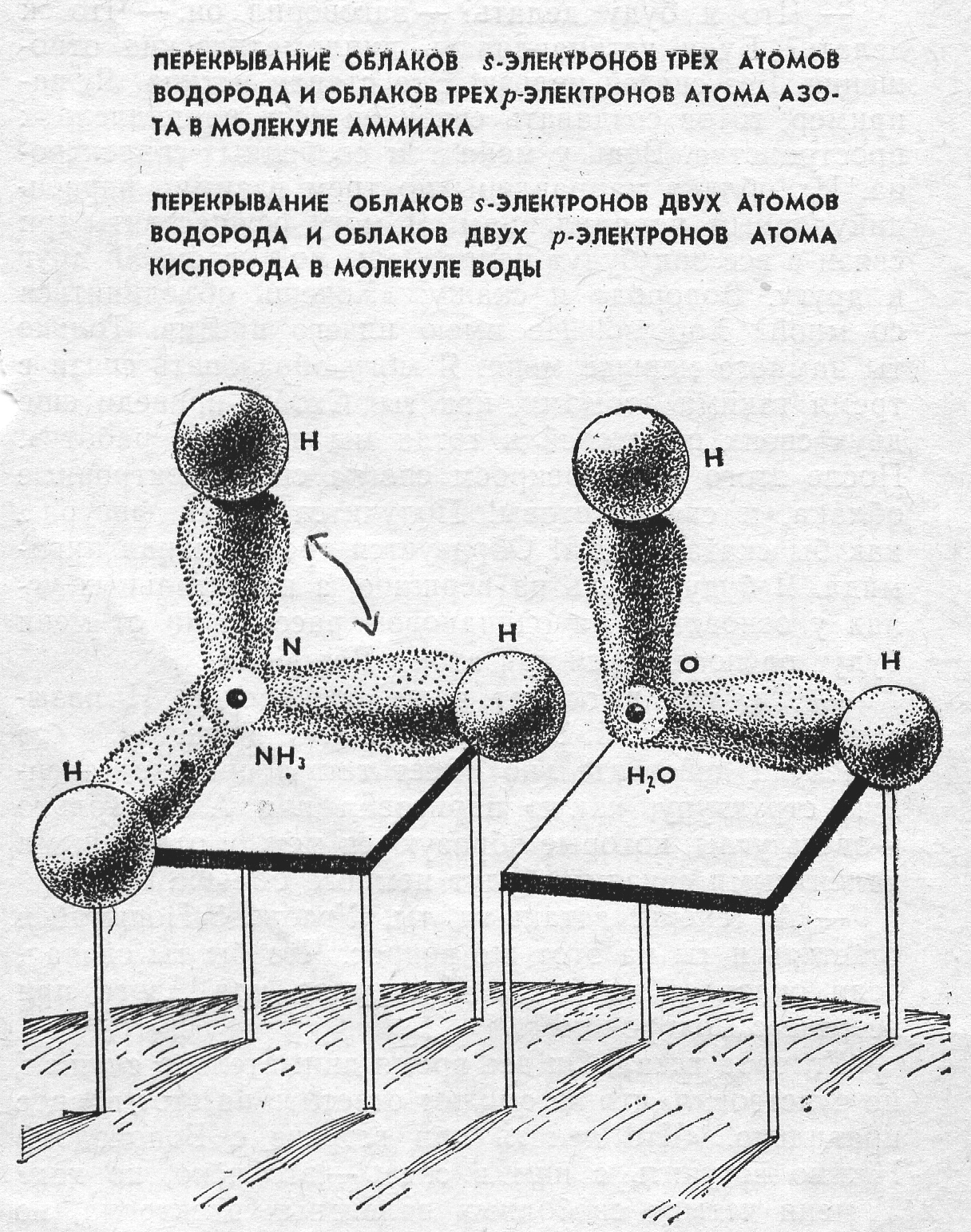
Образование молекул NH3 и Н2О
