
- •3) Основные понятия химии. Закон постоянства состава. Закон эквивалентов. Молярная масса эквивалентов. Молярный объем эквивалентов.
- •4) Квантово-механическая модель атома. Строение ядер и электронных оболочек.
- •5)Квантовые числа. Электронные конфигурации атомов.
- •6) Принцип наименьшей энергии. Принцип Паули. Правило Хунга.
- •7)Периодический закон д. И. Менделеева. Структура псхэ : периоды, ряды, семейства, s-, p-, d-, f-классификация элементов.
- •8) Химическая связь и ее характеристики. Типы хим. Связей.
- •9) Ионная связь.
- •10) Ковалентная связь.
- •11)Метод валентных связей.
- •12) Метод молекулярных орбиталей.
- •13) Межмолекулярные взаимодействия.
- •14) Водородная связь.
- •Межмолекулярная и внутримолекулярная водородная связь
- •15) Металлическая связь.
- •16) Основные понятия термодинамики.
- •17)Энтальпия. Теплота. Работа. Первый закон термодинамики.
- •Следствия из закона Гесса
- •19) Энтропия и второй закон термодинамики. Энергия Гиббса.
- •100% Энергии не может быть преобразовано в работу
- •20) Основные положения химической кинетики. Скорость хим. Реакции. Порядок и молекулярность хим. Реакции.
- •21) Зависимость скорости хим. Реакции от температуры.
- •22)Принцип Ле-Шателье.
- •24) Растворы: понятие, классификация. Способы выражения концентрации.
- •26) Осмотический закон Вант-Гоффа.
- •28) Ионное произведение воды. PH водных растворов.
- •Ионное произведение воды
- •29) Качественный анализ. Классификация методов. Требования, предъявляемые к реакциям в качественном анализе. Примеры.
- •30) Классификация методов количественного анализа. Сущность титриметрического метода анализа, основные приемы титрования. Индикаторы кистно-основного титрования.
- •31) Обратимость химических реакций.
6) Принцип наименьшей энергии. Принцип Паули. Правило Хунга.
-
В атоме каждый электрон располагается
так, чтобы его энергия была минимальной
(что отвечает наибольшей связи его с
ядром).
Энергия электрона в основном
определяется главным квантовым числомnи побочным квантовым
числомl, поэтому сначала
заполняются те подуровни, для которых
сумма значений квантовых чиселnиl является наименьшей.
Например, энергия электрона на подуровне
4sменьше, чем на подуровне
3d, так как в первом случаеn+ 1 = 4 + 0 = 4, а во второмn +l= 3 + 2 =5; на подуровне 5s(n+l= 5 + 0 =
5) энергия меньше, чем на 4d(n +l= 4 +
2 = 6); на 5р (n +l= 5 + 1 = 6) энергия меньше, чем на 4f(n +l= 4 +
3 = 7) и т.д.
В.М. Клечковский впервые в
1961 г. сформулировал общее положение,
гласящее, что электрон занимает в
основном состоянии уровень не с
минимальным возможным значениемn,
а с наименьшим значением суммыn+l.
В том случае, когда
для двух подуровней суммы значенийnиl равны, сначала идет
заполнение подуровня с меньшим значениемn. Например, на подуровнях
Зd, 4р, 5sсумма значенийnи l равна
5. В этом случае происходит сначала
заполнение подуровней с меньшими
значениямиn, т.е. Зd -
4р – 5sи т.д. В периодической
системе элементов Менделеева
последовательность заполнения электронами
уровней и подуровней выглядит следующим
образом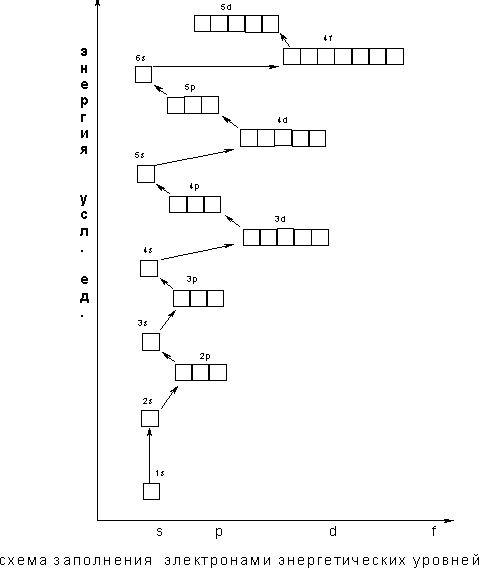 Следовательно,
согласно принципу наименьшей энергии
во многих случаях электрону энергетически
выгоднее занять подуровень «вышележащего»
уровня, хотя подуровень "нижележащего"
уровня не заполнен
Следовательно,
согласно принципу наименьшей энергии
во многих случаях электрону энергетически
выгоднее занять подуровень «вышележащего»
уровня, хотя подуровень "нижележащего"
уровня не заполнен
Именно
поэтому в четвертом периоде сначала
заполняется подуровень 4s и
лишь после этого подуровень Зd.
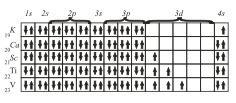

Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так
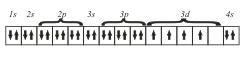
хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная (как и еще у одного элемента 29Сr).
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие
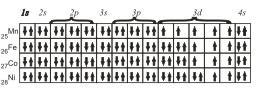
Наконец, последние восемь элементов четвертого периода имеют конфигурации
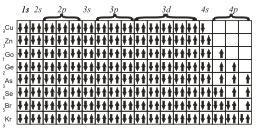
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
7)Периодический закон д. И. Менделеева. Структура псхэ : периоды, ряды, семейства, s-, p-, d-, f-классификация элементов.
- "Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса". Современная формулировка: "свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2
