
- •Утверждено на заседании цкмс агму
- •Программа по фармацевтической химии Неорганические и металлорганические лекарственные средства
- •Органические лекарственные вещества Алифатические соединения
- •Тематический план занятий по фармацевтической химии для студентов 3 курса (осенний семестр)
- •Тематический план лекций по фармацевтической химии для студентов 3 курса (осенний семестр)
- •Правила внутреннего распорядка в аудитории Обязанности студентов
- •Обязанности дежурного
- •Правила пользования оборудовнием, посудой и реактивами в лаборатории
- •Правила техники безопасности при работе в химической лаборатории
- •Меры первой помощи при несчастных случаях
- •Форма ведения протокола лабораторного занятия по фармацевтической химии
- •Тема I. Общие методы и приемы определения подлинности, чистоты и количественного содержания лекарственных средств
- •План занятия
- •Контрольные вопросы по изучаемой теме
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Задание 1. Идентификация лекарственных препаратов химическими методами
- •Кислота бензойная (фс 9, гф х)
- •Контрольные вопросы по изучаемой теме
- •Литература:
- •План занятия
- •Общие правила проведения испытаний на чистоту и допустимые пределы примесей
- •Вопросы для подготовки к собеседованию по изучаемой теме
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Тема II. Анализ неорганических лекарственных соединений
- •Контрольные вопросы по смежным дисциплинам
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Вопросы для подготовки к собеседованию по теме «Галогены и их соединения как лекарственые средства»
- •План занятия
- •Вопросы для подготовки к собеседованию по теме «Кислород и его соединения. Соединения углерода и бора»
- •Занятие 9. Анализ неорганических лекарственных соединений кальция, магния, бария, алюминия, нитритов, тиосульфатов
- •Контрольные вопросы по смежным дисциплинам
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Вопросы для подготовки к собеседованию
- •Контрольные вопросы по смежным дисциплинам
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Вопросы для подготовки к собеседованию
- •Вопросы для подготовки к контрольной работе
- •Тестовые задания
- •28. Определите, верны или нет каждое из приведенных утверждений и причинно-следственная связь между ними.
- •Тема III. Анализ алифатических препаратов галогенопроизводных алканов, альдегидов, спиртов, углеводов, эфиров
- •Литература:
- •План занятия
- •Задание 3. Экспресс-анализ раствора гексаметилентетрамина
- •Количественное определение
- •Занятие 13. Препараты моно-, ди- и полисахаридов, спиртов, простых алифатических эфиров, сложных эфиров
- •Контрольные вопросы по смежным дисциплинам
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Декстрин
- •Задание 2. Фармакопейный анализ препарата
- •Тема IV. Препараты карбоновых кислот, аминокислот алифатического ряда, лактонов ненасыщенных полиоксикислот
- •Контрольные вопросы по смежным дисциплинам
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Задание 3. Экспресс-анализ лекарственной смеси
- •Подлинность
- •Контрольные вопросы по смежным дисциплинам
- •Контрольные вопросы по изучаемой теме
- •План занятия
- •Задание 1. Фармакопейный анализ кислоты глютаминовой ( фс 15, гф X, сокращенный вариант)
- •Подлинность.
- •Занятие 17. Контрольная работа по теме «Анализ препаратов карбоновых кислот и аминокислот, лактонов ненасыщенных полиосикарбоновых кислот»
- •Занятие 18-19. Теоретический контроль по теме «Анализ лекарственных веществ по функциональным группам»
Контрольные вопросы по изучаемой теме
Классификация методов количественного анализа: физические, физико-химические, химические, биологические.
Сущность физических методов: определение концентрации по плотности. Использование в анализе лекарственных препаратов.
Сущность физико-химических методов: оптические методы – рефрактометрия, поляриметрия, спектрофотометрия в ультрафиолетовой и видимой области спектра, фотоэлектроколориметрия, спектрофотометрия в инфракрасной области, фототурбидиметрия, нефелометрия, флуориметрия; электрохимические методы-потенциометрия, полярография, адсорбционные (хроматографические)-хроматография на бумаге, тонкослойная хроматография, газожидкостная и высокоэффективная жидкостная хроматография.
Сущность химических (титриметрических) методов анализа: методы осадительного титрования-аргентометрия, тиоционатометрия, меркуриметрия; кислотно-основное титрование в водных средах – прямая, обратная и косвенная ациди- и алкалиметрия; кислотно-основное титрование в неводных средах; методы окислительно-восстановительного титрования – иодометрия, броматометия, иодхлорметрия, перманганатометрия, цериметрия, нитритометрия; комплексонометрия; гравиметрия.
Основные требования, предъявляемые к реакциям, используемым в количественном определении лекарственных веществ.
Расчет количества титранта, исходной навески определяемого вещества.
Расчет процентного содержания вещества в прямом, обратном и косвенном (заместительном) титровании.
Математическая обработка результатов анализа.
Литература:
Государственная Фармакопея СССР. X изд. – М.: Медицина, 1965.
Государственная Фармакопея СССР. XI изд., ч. 1,2. – М.: Медицина, 1987.
Беликов В.Г. Фармацевтическая химия. – М.: Высшая школа, 1985.
Беликов В.Г. Фармацевтическая химия. – Пятигорск, 2003.
Арзамасцев А.П. Руководство к лабораторным занятиям по фармацевтической химии. – М.: МЕДИЦИНА, 1987.
Арзамасцев А.П. Фармацевтическая химия / учебное пособие для вузов. – М.: ГЭОТАР-Медиа, 2005.
Пономарев В.Д. Аналитическая химия. – М.: Высшая школа, 1982. – т. I, II.
План занятия
Семинар по теме занятия: классификация и основы методов количественног анализа.
Теоретический контроль знаний студентов: химические (титриметрические) и физико-химические методы количественного анализа.
Решение ситуационных задач (составление формул расчета содержания лекарственных веществ в различных вариантах методов количественного анализа).
Самостоятельная работа студентов:
Задание I. Проведение количественного анализа раствора натрия сульфацила 20 % тремя методами – нитритометрическим, ацидиметрическим, рефрактометрическим.
Задание 2. Статистическая обработка результатов и оценка указанных методов количественного анализа.
Оформление и защита протоколов, приведение в порядок рабочего места.
Задание 1. Количественный анализ раствора натрия сульфацила 20 %
Готовят разведение препарата: 2 мл раствора натрия сульфацила берут мерной пипеткой и помещают в мерную колбу емкостью 50 мл, доводят водой до метки.
Определение нитритометрическим методом
10 мл разведения берут мерной пипеткой и помещают в колбу для титрования вместимостью 250 мл, добавляют 20 мл разведенной кислоты хлороводородной, 1 грамм калия бромида и добавляют воды (цилиндром) до общего объема 80 мл, затем добавляют 4 капли индикатора нейтрального красного и титруют 0,1 М раствором натрия нитрита до перехода окраски раствора от малиновой до синей.
В конце титрования (за 0,5 мл до точки эквивалентности) титруют медленно со скоростью 0,05 мл титранта в минуту. Параллельно проводят контрольный опыт.
Определение методом кислотно-основного титрования (ацидиметрическим методом)
10 мл разведения берут мерной пипеткой и помещают в колбу для титрования на 100 мл, добавляют 2 капли метилового оранжевого и 1 каплю метиленового синего и титруют 0,1н. раствором кислоты хлороводородной до перехода окраски раствора от зеленой до фиолетовой.
Определение рефрактометрическим методом.
Помещают на призму рефрактометра 3-4 капли раствора препарата и измеряют показатель преломления, предварительно измерив показатель преломления воды. Определение повторяют три раза и берут среднее значение для расчета содержания лекарственного вещества в препарате, с помощью рефрактометрических таблиц.
Задание 2. Статистическая обработка результатов и оценка указанных методов количественного анализа
1.
![]() /среднее значение/
/среднее значение/
![]()
2.
S
/среднеквадратичное отклонение/
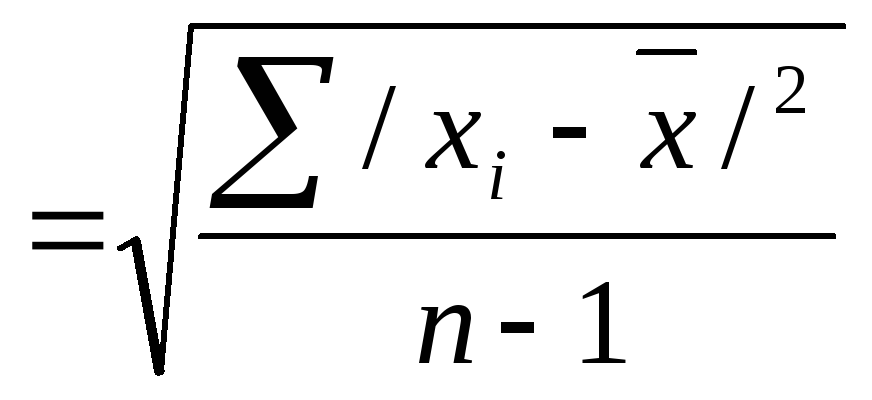

![]()
![]() –абсолютная
ошибка среднего значения
–абсолютная
ошибка среднего значения
![]() –коэффициент
Стьюдента для 95 % надежности и к
степени свободы
–коэффициент
Стьюдента для 95 % надежности и к
степени свободы
![]() –доверительный
интервал
–доверительный
интервал
Занятие № 6. Контрольная работа по теме: «Общие методы и приемы определения подлинности, чистоты и количественного содержания лекарственных средств»
Контроль знаний студентов проводится в виде тестового контроля и коллоквиума-собеседования по билетам.
Вопросы для подготовки к контрольной работе смотри в занятиях № 1, 2, 3,4,5-«контрольные вопросы по теме» и вопросы для подготовки к собеседованию по изучаемой теме в МУ для самостоятельной работы студентов 3 курса по фармацевтической химии (с. 15-16).
